Obrázok od LJNovaScotia z Pixabay
Simona Čerteková
Slovenská poľnohospodárska univerzita v Nitre, Fakulta biotechnológie a potravinárstva
Čo je CRISPR
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) sú charakteristické úseky v DNA nachádzajúce sa vo veľkej časti prokaryotov (baktérií a archeónov), o ktorých už dnes vieme, že slúžia najmä na ochranu voči vírusovým infekciám. Už na prelome 80. – 90. rokov minulého storočia boli prvýkrát publikované informácie o zvláštnych, palindromatických, pravidelne sa opakujúcich sekvenciách. Ich funkcia však pre vedcov zostávala ešte niekoľko desaťročí záhadou. Hypotéza, že CRISPR môže predstavovať akúsi adaptívnu formu imunity baktérií sa začala formovať až keď boli publikované zistenia, že tzv. spacer sekvencie, čiže poradia nukleotidov medzi jednotlivými palindromatickými repetíciami v CRISPR lokuse (konkrétny úsek v bakteriálnej DNA, v ktorom sú umiestnené CRISPR sekvencie), sa zhodujú so sekvenciami DNA niektorých bakteriofágov.
CRISPR proces
Celý proces CRISPR imunity môžeme rozdeliť do troch základných fáz: adaptívna fáza, fáza expresie a fáza interferencie. Po prekonaní vírusovej infekcie, sú baktérie a archeóny obsahujúce CRISPR sekvencie schopné zachytiť časti nukleovej kyseliny pochádzajúcej z inváznych vírusov. Tieto krátke úseky DNA sú následne uložené medzi opakujúce sa sekvencie CRISPR, pričom tvoria spomínané spacer sekvencie. Túto fázu nazývame aj adaptívna fáza, počas ktorej si baktéria vytvára akúsi knižnicu, v ktorej sú uložené sekvencie bakteriofágov, ktoré by ju v budúcnosti mohli opätovne infikovať. Nasleduje fáza expresie alebo biogenézy CRISPR, v ktorej dochádza ku transkripcií CRISPR lokusu za vzniku molekúl crRNA (CRISPR RNA, ktorá spolu s tracrRNA tvorí tzv. vodiacu gRNA). Každá crRNA má sekvenciu odvodenú od konkrétneho bakteriofága. V literatúre sa často stretávame aj s označením CRISPR/Cas. Cas je rodina proteínov, patriacich do skupiny endonukleáz, čiže enzýmov schopných štiepiť nukleotidové reťazce DNA molekúl. crRNA nesúca informáciu o sekvencií charakteristickej pre patogénny vírus sa vo forme gRNA spojí s Cas proteínom za vzniku aktívneho CRISPR/Cas komplexu. V prípade, že dôjde k stretu tohoto komplexu s vírusom napádajúcim bunku, hovoríme už o fáze interferencie. CRISPR/Cas komplex je v prípade reinfekcie schopný rozpoznať invázny vírus vďaka komplementarite poradia báz v crRNA s vírusovou sekvenciou. Vďaka aktivite enzýmu Cas je tento komplex zároveň schopný rozštiepiť nukleovú kyselinu vírusu a tým ho včas zneškodniť. CRISPR a Cas teda tvoria efektívny tím, slúžiaci na zacielenie a zneškodnenie vírusov po ich vniknutí do prokaryotickej bunky. Rozhodujúcou pre poštiepenie sprostredkované enzýmom Cas je prítomnosť krátkej 2-6 nukleotidovej sekvencie v cieľovej nukleovej kyseline vírusu. Táto sekvencia sa nazýva PAM a nie je prítomna v CRISPR lokuse, vďaka čomu komplex CRISPR/Cas neštiepi DNA vlastnej bunky.
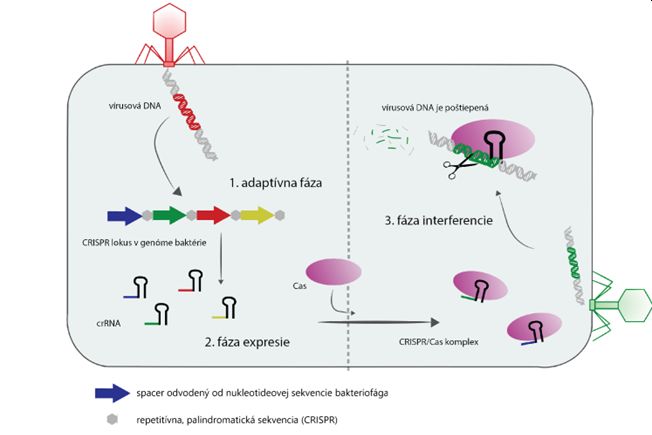
CRISPR/Cas komplexy boli identifikované v približne 50 % bakteriálnych genómov a až v 95 % genómov archeónov, pričom v odlišných organizmoch boli pozorované rôzne podoby tohto systému. Všeobecne môžeme CRISPR/Cas systémy rozdeliť do dvoch tried a šiestich podtried, líšiacich sa najmä štruktúrou CRISPR lokusu a prítomnosťou rôznych typov Cas proteínov. Neustále evolučné preteky medzi baktériami a bakteriofágmi zapríčinili, že u mnohých vírusov došlo k vzniku mutácií, ktoré im umožňujú efektívne sa vyhnúť rozpoznaniu a degradácií CRISPR/Cas systémom. Takýmto spôsobom dochádza k neustálym, vzájomným zmenám v CRISPR lokuse baktérií a taktiež v genóme bakteriofágov.
CRISPR/Cas ako nástroj na editovanie genómu
V roku 2012 vedkyne Jennifer Doudna a Emmanuelle Charpentier izolovali CRISPR/Cas systém z baktérie Streptococcus pyogenes a upravili ho tak, aby dokázal zacieliť akúkoľvek sekvenciu DNA. Umelým nasyntetizovaním vodiacej RNA, dokázali naprogramovať CRISPR/Cas systém tak, aby štiepil cieľovú DNA v presne definovanom mieste. Keď potom do bunky s takto poškodenou DNA dopravili špeciálne nasyntetizovaný úsek DNA s ľubovoľnou sekvenciou, bunka ho použila ako templát – vzor, podľa ktorého vzniknuté poškodenie zacelila. Takýmto spôsobom dnes vedci dokážu veľmi jednoducho inkorporovať akúkoľvek sekvenciu do genómu nielen vírusov a prokaryotických buniek, ale aj eukaryotických buniek, akými sú napríklad bunky rastlín alebo živočíchov. Po začlenení je táto nová sekvencia súčasťou genetického materiálu bunky a prechádza aj do jej dcérskych buniek. V roku 2020 bola týmto vedkyniam za ich významný objav udelená aj Nobelova cena za chémiu. Používanie CRISPR/Cas je v porovnaní so staršími metódami umožňujúcimi úpravu genómu omnoho jednoduchšie, lacnejšie a navyše poskytuje aj vyššiu presnosť a precíznosť. CRISPR/Cas systém má v závislosti od použitého Cas proteínu veľmi variabilné využitie a možno pomocou neho teda nielen vkladať do buniek nové gény, ale napríklad aj inaktivovať už prítomné gény, potlačiť ich expresiu alebo ju naopak stimulovať. Vďaka svojim vlastnostiam sa touto technológiou zaoberajú vedci z rôznych odvetví.
Aplikácie CRISPR/Cas technológie
Medicína
Veľmi intenzívny výskum využitia CRISPR/Cas v súčasnosti prebieha v oblasti medicíny. Terapie založené na CRISPR/Cas sú dnes vyvíjané pre širokú škálu chorôb ako napríklad vrodené ochorenia oka, neurodegeneratívne ochorenia, ako sú Alzheimerova a Huntingtonova choroba a taktiež aj nededičné ochorenia ako rakovina a HIV. Vedcom sa napríklad pomocou CRISPR/Cas9 podarilo obnoviť zrak laboratórnemu potkanovi, ktorý trpel vrodenou poruchou sietnice. Využitie CRISPR/Cas však v tejto oblasti nezostalo iba v rovine výskumu a už v roku 2019 bola terapia založená na tejto báze podaná prvým pacientom, trpiacim kosáčikovou anémiou. Pri takejto liečbe je pacientovi odobratá kostná dreň, ktorej bunky sú ex vivo upravené pomocou CRISPR/Cas technológie tak, aby produkovali fetálny hemoglobín. Tento typ hemoglobínu je za bežných okolností u ľudí produkovaný len počas fetálneho štádia vývinu, avšak je schopný veľmi efektívne viazať kyslík. Takto upravené bunky sa následne vrátia do tela pacienta, kde ďalej produkujú spomínaný hemoglobín, čím je dosiahnuté signifikantné zníženie potreby krvných transfúzií a tiež výrazná redukcia bolestivých prejavov ochorenia.
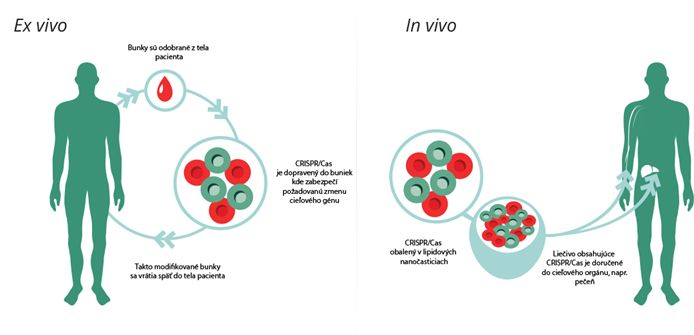
Ďalšou veľmi zaujímavou možnosťou by mohlo byť využitie CRISPR/Cas ako cieleného, vysoko špecifikovaného antibiotika. Takýmto spôsobom by bolo možné naprogramovať CRISPR/Cas na zničenie baktérií, u ktorých bola vyvinutá rezistencia voči konvenčným antibiotikám a taktiež by bolo možné zacieliť len na skupinu konkrétnych, patogénnych baktérií bez toho, aby došlo k poškodeniu prospešných, komenzálnych baktérií. Uvažuje sa taktiež o tom, že takéto cielené liečivo by mohlo byť využité aj voči eukaryotickým parazitom alebo vírusom, ako napríklad HIV vírus, ľudsky papilomavírus alebo vírus hepatitídy typu B.
Medicína sa intenzívne zaoberá aj problémom nedostatku darcovských orgánov vhodných na transplantáciu. Jedným z možných riešení by mohla byť práve xenotransplatnácia, kedy sa nefunkčný orgán príjemcu nahradí zdravým orgánom získaným z iného živočíšneho druhu (napríklad z prasiat). U všetkých typov transplantácie orgánov však hrozí riziko odmietnutia darcovského orgánu príjemcom. V prípade xenotranplantácie je tento jav vyvolaný vytvorením imunitnej odpovede voči antigénom nachádzajúcim sa v tkanivách iného živočíšneho druhu. Ďalším rizikom xenotransplantácií je vytvorenie infekcie spôsobenej retrovírusmi nachádzajúcimi sa v genóme živočíchov. Tieto retrovírusy sú síce voči svojim pôvodným hostiteľom nepatogénne, avšak pri prekročení druhovej bariéry sú schopné spôsobovať ochorenia. Úpravou genómu napríklad pomocou CRISPR/Cas by sa mohlo docieliť nie len zníženie rizika odmietnutia xenotransplantátu a prenosu vírusových zoonóz ale aj zvýšenie kompatibility a celkové zlepšenie funkcie transplantovaného orgánu.
Poľnohospodárstvo a potravinárstvo
V poľnohospodárstve sa CRISPR/Cas už dnes využíva v komerčných a modelových plodinách na zvýšenie výnosu, zlepšenie tolerancie rastlín voči biotickým a abiotickým stresom alebo na zlepšenie ich nutričných hodnôt. Vďaka CRISPR/Cas by sa mohol taktiež zefektívniť chov hospodárskych zvierat. Šľachtitelia dnes už pomerne dobre poznajú miesta v genóme živočíchov, zodpovedné za cenné vlastnosti ako napríklad mäsová úžitkovosť, produkcia mlieka, ale aj gény zodpovedné sa tvorbu rohov.
Predstava konzumácie CRISPR/Cas upravených potravín vyvoláva u ľudí rôzne emócie, či už pozitívne alebo skôr naopak negatívne. Prirodzený CRISPR/Cas systém je však bežnou súčasťou baktérií, ktoré používame napríklad na výrobu jogurtov. Prvýkrát bol v skutočnosti tento systém experimentálne dokázaný výskumníkmi potravinárskej spoločnosti Danisco, práve v štartovacích kultúrach Streptococcus thermophilus, používaných pri mliečnej fermentácií jogurtov. Vírusy dokážu v procese výroby štartovacích kultúr spôsobiť nemalé straty. Z tohto dôvodu sa komerční výrobcovia kultúr baktérií mliečneho kvasenia často zameriavajú na produkciu kmeňov s rozsiahlymi CRISPR lokusmi, ktoré im zabezpečujú odolnosť voči vírusom.
Génové hnanie
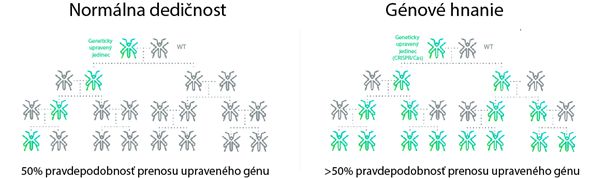
Génové hnanie (z angl. gene drive) je evolučný jav, pri ktorom sa určité úseky genómov dedia z generácie na generáciu efektívnejšie než iné, pričom takéto úseky označujeme aj ako sebecké. Pôvodne ide o prirodzene sa vyskytujúci proces, avšak CRISPR/Cas vieme použiť aj na vytvorenie takéhoto génového hnania. Inými slovami, CRISPR/Cas môže zabezpečiť cielenú propagáciu želaného génu v populácií, čo by mohlo mať masívne dôsledky na celé ekosystémy. Do dnešného dňa bola v laboratórnych podmienkach táto technológia úspešne aplikovaná napríklad v kvasinkách, vínnych muškách alebo komároch. Špecifická pozornosť sa venuje najmä spomínaným komárom a iným vektorom prenášajúcim ochorenia, pri ktorých by CRISPR/Cas indukované génové hnanie mohlo zabrániť ich šíreniu. Anopheles gambiae, je druh komára, prenášajúci maláriu, ktorá najmä v subsaharskej oblasti ročne zabíja stovky tisíc ľudí. Mutácia v géne nazývanom doublesex zapríčiňuje v samičích jedincoch deformácie ústnych orgánov a tiež pohlavných orgánov, čo má za následok neschopnosť uhryznúť a klásť vajíčka. Podľa predbežných predpokladov, by malária mohla byť pomocou indukovaného génového hnania aplikovaného na 1% divokej populácie komárov eradikovaná v horizonte jedného roka. CRISPR/Cas indukované génové hnanie umožňuje zmeny doteraz nevídaných rozmerov a mohlo by ovplyvniť celé ekosystémy a budúce generácie, zároveň má aj potenciál úplne eradikovať ochorenia, na ktoré zomiera veľká časť svetovej populácie. Ako pri každej vznikajúcej technológii, prípadná úspešná implementácia v širokom meradle si bude vyžadovať ešte veľmi intenzívny a dôkladný výskum, súhlas regulačných orgánov a akceptovanie širokou verejnosťou.
Budúcnosť CRISPR/Cas
Najkontroverznejšou témou v súvislosti s CRISPR/Cas jednoznačne zostáva možnosť editácie ľudských zárodočných buniek. V prípade geneticky upravených embryí by sa táto modifikácia preniesla do všetkých buniek daného jedinca a taktiež aj na jeho potomstvo. Výskumníci vrátane už spomínanej autorky tejto technológie Jennifer Doudna vyzvali na moratórium v oblasti úpravy ľudskej zárodočnej línie a požadujú transparentnú a otvorenú, medzinárodnú diskusiu medzi odborníkmi, nie len vedcami ale aj právnikmi, bioetikmi a širokou verejnosťou, ktorá by zvážila všetky aspekty takéhoto zásahu.
Medzi hlavné problémy, ktoré je potrebné vyriešiť pre úspešné a bezpečné aplikovanie technológie CRISPR/Cas patrí stále pomerne veľké riziko neúmyselných mutácií v príbuzných sekvenciách. Prípadná nízka účinnosť modifikácie zas môže v niektorých prípadoch viesť k vzniku chimérického organizmu, obsahujúceho bunky s dvoma rozličnými druhmi genotypov. Keďže Cas proteíny sa najčastejšie získavajú z baktérií Streptococcus pyogenes a Staphylococcus aureus, ktoré radíme medzi patogénne baktérie, mnoho ľudí môže mať voči ich proteínom vybudovanú už existujúcu formu imunitnej odpovede. Pre bezpečnú a efektívnu aplikáciu CRISPR/Cas v širšom meradle, je teda ešte potrebné prekonať mnohé prekážky.
Faktom je, že CRISPR/Cas patrí k najrevolučnejším technológiám posledných desaťročí, a jej prípadné aplikácie by mohli mať v budúcnosti obrovský dopad na mnohé oblasti našej spoločnosti. Technológie založené na CRISPR/Cas sa budú nepochybne aj naďalej podieľať na transformácií základného a aplikovaného biotechnologického výskumu. Súčasne s pokrokom v tejto oblasti sú pre úspešnú budúcnosť CRISPR/Cas technológie potrebné aj dôkladné štúdie zamerané na riešenie jej bezpečnosti a špecifickosti. Je potrebné taktiež venovať pozornosť sociálnym a etickým dôsledkom takýchto technológií, pretože len tak môžu byť prospešné pre celé ľudstvo.
Použitá literatúra
Doudna, J. A., & Charpentier, E. (2014). The new frontier of genome engineering with CRISPR-Cas9. Science, 346(6213). https://doi.org/10.1126/science.1258096
Knott, G. J., & Doudna, J. A. (2018). CRISPR-Cas guides the future of genetic engineering. Science, 361(6405), 866-869. https://doi.org/10.1126/science.aat5011
Sternberg, S. H., & Doudna, J. A. (2015). Expanding the biologist’s toolkit with CRISPR-Cas9. Molecular cell, 58(4), 568-574. https://doi.org/10.1016/j.molcel.2015.02.032
Wright, A. V., Nuñez, J. K., & Doudna, J. A. (2016). Biology and applications of CRISPR systems: harnessing nature’s toolbox for genome engineering. Cell, 164(1-2), 29-44. https://doi.org/10.1016/j.cell.2015.12.035
Barrangou, R., Doudna, J. A. (2016). Applications of CRISPR technologies in research and beyond. Nat Biotechnol 34,933–941. https://doi.org/10.1038/nbt.3659
Fellmann, C., Gowen, B. G., Lin, P. C., Doudna, J. A., & Corn, J. E. (2017). Cornerstones of CRISPR–Cas in drug discovery and therapy. Nature reviews Drug discovery, 16(2), 89-100. https://doi.org/10.1038/nrd.2016.238
O’Connell, M. R., Oakes, B. L., Sternberg, S. H., East-Seletsky, A., Kaplan, M., & Doudna, J. A. (2014). Programmable RNA recognition and cleavage by CRISPR/Cas9. Nature, 516(7530), 263-266. https://doi.org/10.1038/nature13769
Kyrou, K., Hammond, A. M., Galizi, R., Kranjc, N., Burt, A., Beaghton, A. K., … & Crisanti, A. (2018). A CRISPR–Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature biotechnology, 36(11), 1062-1066. https://doi.org/10.1038/nbt.4245
Adli, M. (2018). The CRISPR tool kit for genome editing and beyond. Nature communications, 9(1), 1-13. https://doi.org/10.1038/s41467-018-04252-2
Jiang, F., & Doudna, J. A. (2017). CRISPR–Cas9 structures and mechanisms. Annual review of biophysics, 46, 505-529. https://doi.org/10.1146/annurev-biophys-062215-010822
Kick, L., Kirchner, M., & Schneider, S. (2017). CRISPR-Cas9: from a bacterial immune system to genome-edited human cells in clinical trials. Bioengineered, 8(3), 280-286. https://doi.org/10.1080/21655979.2017.1299834
Ishino, Y., Shinagawa, H., Makino, K., Amemura, M., & Nakata, A. (1987). Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. Journal of bacteriology, 169(12), 5429-5433. https://doi.org/10.1128/jb.169.12.5429-5433.1987
Jansen, R., Embden, J. D. V., Gaastra, W., & Schouls, L. M. (2002). Identification of genes that are associated with DNA repeats in prokaryotes. Molecular microbiology, 43(6), 1565-1575. https://doi.org/10.1046/j.1365-2958.2002.02839.x
Mojica, F. J., Díez‐Villaseñor, C., Soria, E., & Juez, G. (2000). Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria. Molecular microbiology, 36(1), 244-246. https://doi.org/10.1046/j.1365-2958.2000.01838.x
Rath, D., Amlinger, L., Rath, A., & Lundgren, M. (2015). The CRISPR-Cas immune system: biology, mechanisms and applications. Biochimie, 117, 119-128. Rath, D., Amlinger, L., Rath, A., & Lundgren, M. (2015). The CRISPR-Cas immune system: biology, mechanisms and applications. Biochimie, 117, 119-128.

Leave a Reply