Zuzana Šramková, Miroslava Hlebová
Univerzita Svätého Cyrila a Metoda v Trnave, Fakulta prírodných vied, Katedra biológie
Krátko po zavedení antibiotík do praktického používania sa medzi patogénnymi baktériami objavil a rozšíril fenomén rezistencie. Tento problém je v súčasnosti taký vážny, že sa nazýva aj „kríza antibiotickej rezistencie“ a jej dopady sú dramatické, s približne 700-tisíc prípadmi úmrtí ročne spôsobenými bakteriálnymi kmeňmi odolnými voči antibiotikám. Odhaduje sa, že ak sa neobjavia žiadne nové antibakteriálne lieky, do roku 2050 sa tento počet zvýši na 30 miliónov. Existuje preto naliehavá potreba rozvoja nových antibakteriálnych terapeutických prístupov. Alarmujúci nárast mikrobiálnej rezistencie spojený s nedostatkom inovácií v oblasti antibiotík obnovil záujem o vývoj alternatívnych prístupov v liečbe bakteriálnych infekcií. Jedna z možných nových antibakteriálnych terapií je využitie bakteriofágmi kódovaných enzýmov.
Základná charakteristika a výskyt bakteriofágov
Bakteriofágy (fágy) sú predátormi baktérií. Fágy sú vlastne vírusy, ktoré špecificky infikujú baktérie. Každá infekcia spôsobená fágom je iniciovaná adsorpciou (t.j. pripojením fágovej častice na hostiteľskú bakteriálnu bunku), ktorá je charakterizovaná špecifickým rozpoznaním receptora nachádzajúceho sa na povrchu bakteriálnej bunky. Následne musia fágy preniknúť cez bunkový obal baktérie predstavujúci bariéru rozličnej štruktúry a zloženia, a nakoniec injektujú svoj genetický materiál do cytoplazmy baktérií. Niektoré baktérie produkujú kapsulárne polysacharidy (CPS; tiež nazývané K-antigény), ktoré sú pevne pripojené k bunke. Iné baktérie vylučujú do prostredia hlien s extracelulárnymi polysacharidmi (EPS) počas tvorby biofilmu. CPS aj EPS majú obrovskú rozmanitosť v zložení, nielen v rámci bakteriálneho rodu, ale aj v rámci druhu a toto zloženie sa tiež môže meniť v závislosti od rastovej fázy a podmienok prostredia. Gramnegatívne baktérie sú charakterizované vonkajšou membránou zloženou z lipopolysacharidových (LPS) molekúl s vysoko variabilným O-polysacharidom (O-antigén), zatiaľ čo u grampozitívnych baktérií sú základnými stavebnými jednotkami (lipo)teichoové kyseliny zabudované v peptidoglykáne (PG). Tieto polysacharidy sú často primárnym receptorom s inými vyčnievajúcimi štruktúrami bunkovej steny, ako sú pili a bičíky.
Bakteriofágy predstavujú najpočetnejšie biologické entity na Zemi, a zároveň takmer neobmedzený sortiment geneticky a morfologicky rôznorodých predátorov vhodný na využitie napríklad v medicíne ako prirodzené antimikrobiálne látky. Rôzne infekčné mechanizmy a špecializované fágové receptor- viažuce proteíny poskytujú bezkonkurenčnú špecifickosť voči danej populácii baktérií, ktorá umožňuje presnú liečbu. Okrem toho, vzhľadom na ich stabilitu a programovateľnosť, môžu byť fágy inštrumentalizované alebo vytvorené ako všestranné tzv. nosiče liečiv alebo vakcín.
Vo všeobecnosti sú fágy všadeprítomné a môžu byť izolované z krvi, moču, cerebrospinálneho moku, séra a ascitickej tekutiny (voľná tekutina v brušnej dutine). Sú izolované aj z environmentálnych zdrojov ako napr. odpadové vody, farmaceutické odpadové vody, iné vodné zdroje, akvakultúra a z pôdy. Fágy sa môžu amplifikovať len v prítomnosti citlivej baktérie, kedy môžu infikovať bunky a intermitentne (striedavo) spôsobiť bunkovú lýzu. Preto sa nachádzajú v akomkoľvek prostredí, kde existujú baktérie. Bakteriofág nepoužíva receptor pre eukaryotické bunky a mechanizmy používané organizmami na vyhýbanie sa účinku antibiotík nezhoršujú jeho aktivitu. Niektoré fágy zmenili mechanizmus inhibície efluxnej pumpy baktérií, čím sa obnovila ich citlivosť na antibiotiká. Na rozdiel od antibiotík si nevyžadujú podávanie viacerých dávok na dosiahnutie rovnakej účinnosti. Sú hostiteľsky špecifické, majú rýchlu exponenciálnu replikáciu a dokážu rýchlo vstúpiť do fázy odumierania, kde dochádza k poklesu bakteriálnych buniek. Na rozdiel od antibiotík neboli pri fágoch pozorované nežiaduce imunitné reakcie, či negatívny vplyv na mikrobiotu ľudí a zvierat. Bakteriofágy sa tiež spájajú s produkciou enzymaticky aktívnych látok (enzýmov), ktoré sú schopné degradovať rôzne komponenty bakteriálnych bunkových obalov, vďaka čomu môžu tieto enzýmy pôsobiť ako liečivo, alebo môžu byť nevyhnutnými zložkami liekov a často dosahujú v porovnaní so samotným vírusom stabilné a predvídateľné výsledky.
Životný cyklus fágov
Fágy majú 3 odlišné životné stratégie pre ich rozmnožovanie sa prostredníctvom hostiteľských baktérií: lytickú (virulentné fágy), lyzogénnu (temperované fágy) a chronickú infekciu (Obrázok 1). Každý z týchto cyklov možno rozdeliť na päť rôznych štádií: adsorpcia, injekcia nukleovej kyseliny, replikácia genetického materiálu, expresia fágových génov, zostavenie viriónov a ďalší prenos. V závislosti od konkrétneho životného štýlu môžu byť bakteriofágy definované ako lytické alebo lyzogénne. Infekcia lytickým fágom vždy vedie k deštrukcii bakteriálnych buniek, zatiaľ čo infekcia lyzogénnym fágom môže mať za následok lýzu alebo lyzogéniu, kedy genóm vírusu ostáva v hostiteľskej bakteriálnej bunke v podobe tzv. profága.
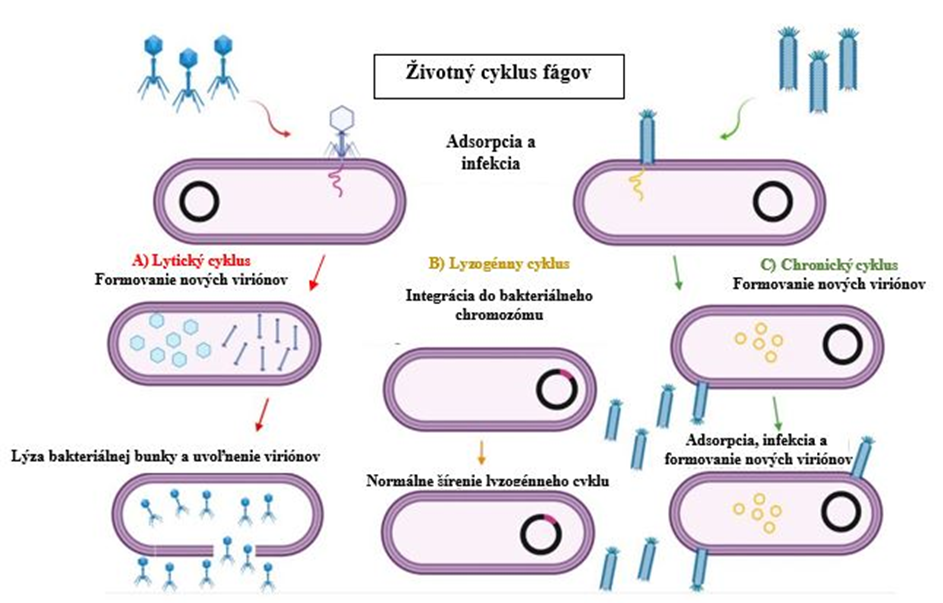
Jedna z najdôležitejších etáp v životnom cykle bakteriofágov je adsorpcia. V tomto kroku sa fág viaže reverzibilne na bunkový povrch, kde rozpozná špecifický receptor. Receptory sú lokalizované vo vonkajšej membráne, na bakteriálnej bunkovej stene, v lipopolysacharidoch alebo v kapsulárnych polysacharidoch, piloch a bičíkoch. Efektívne rozpoznanie fágovo špecifického receptora vedie k prichyteniu vírusu a ďalej injekcii genetického materiálu do hostiteľskej bunky. Tento proces je prísne závislý od prostredia a jeho fyzikálno-chemických faktorov, pH, teploty, dostupnosti živín alebo iónov, ako aj od stavu hostiteľských bakteriálnych buniek. Pretože bakteriofágy sú rozdelené do rôznych skupín v závislosti na type nukleových kyselín (ssDNA, dsDNA, ssRNA, dsRNA), pre každú z týchto skupín sú charakteristické mechanizmy procesu prenikania genetického materiálu do hostiteľskej bunky. Po penetrácii a injekcii nukleovej kyseliny, si lyzogénny bakteriofág môže vybrať medzi dvoma rôznymi vývojovými dráhami – lýza alebo lyzogenéza. Táto voľba závisí nielen na charakteristikách konkrétnej skupiny fágov, ale aj na fyziologickom stave bakteriálnej bunky. V situácii obmedzenia zdroja uhlíka alebo aminokyselín, nízkych teplôt sa rast baktérií spomalí a bakteriofágy si vyberú lyzogéniu, v opačnom prípade začínajú lytický cyklus (Obrázok 1A). V lyzogénnej dráhe sa genóm fága integruje do bakteriálneho genómu a po tomto procese sa baktéria stáva imúnnou voči ďalšej infekcii tým istým fágom (Obrázok 1B). Preto môže byť tento druh korelácie baktéria-fág považovaný za istý druh symbiotického vzťahu. Počas lytického cyklu sa fágový genóm intenzívne replikuje, dochádza k expresii veľkej väčšiny fágových génov a predchádza zostaveniu viriónov – potomstva, lýze hostiteľskej bunky a uvoľneniu novovytvorených bakteriofágov. Posledným typom vývoja fágov je chronická infekcia. Tento cyklus je typický pre vláknité fágy (ako f1, fd a M13), čo je úplne odlišná skupina fágov, pomenovaná pre ich filamentózny (vláknitý) tvar. Vláknité fágy nelyzujú bakteriálne hostiteľské bunky, udržiavajú ich nažive, čo sa dá nazvať tzv. „sociálnym životom bakteriálnych fágov“. Infekcia vláknitými fágmi začína adsorpciou na bakteriálne pili, kde sa nachádzajú potrebné receptory. Potom sa genómový materiál fága injektuje do hostiteľskej bunky a replikuje sa epizomálne (mimojadrovo). Súčasne dochádza k expresii fágových génov a nakoniec sa zostavia a uvoľnia virióny z bunky cez bunkovú stenu hostiteľa procesom náročným na energiu bez usmrtenia bakteriálneho hostiteľa (Obrázok 1C). Odhliadnuc od lyzogénneho cyklu, ktorý v podstate tiež môže prejsť na lytický spôsob, sa vývoj bakteriofága končí uvoľnením potomstva viriónov z hostiteľských buniek, čo zahŕňa deštrukciu bunkovej membrány baktérie a bunkovej steny. Tento proces závisí od pôsobenia fágom kódovaných enzýmov zodpovedných za lýzu bakteriálnej bunky. Preto majú práve fágmi kódované proteíny zapojené do procesu lýzy potenciál nových antibakteriálnych liečiv.
Bakteriofágmi kódované enzýmy a ich pôsobenie na bakteriálne bunky
Fágmi kódované enzýmy – proteíny predstavujú silné antibakteriálne zbrane. Niektoré z nich sa už využívajú ako rekombinantné proteíny a ponúkajú účinný antibakteriálny nástroj, napríklad v boji s tvorbou bakteriálnych biofilmov. Tieto enzýmy zahŕňajú endolyzíny, lyzíny spojené s viriónom (VALs) a polysacharidové depolymerázy. Medzi ďalšie zaujímavé proteíny kódované fágmi patria receptor – viažuce proteíny (RBP), zodpovedné za väzbu fágov na hostiteľské bunky. RBP sú sprostredkovateľmi interakcie medzi fágom a jeho hostiteľom. Tieto proteíny je možné využiť na detekciu cieľovej patogénnej baktérie.
Endolyzíny známe ako peptidoglykánové hydrolázy, sú triedou bakteriofágmi kódovaných enzýmov, ktoré degradujú bunkovú stenu baktérií na konci lytického cyklu. Tieto enzýmy sú schopné štiepiť bakteriálny peptidoglykán (PG) zvnútra bunky, čo vedie k lýze baktérií a uvoľneniu fágového potomstva. Jednou z hlavných funkcií bakteriálneho PG je ochrana pred vysokým vnútorným osmotickým tlakom. V dôsledku pôsobenia endolyzínov dochádza k štiepeniu peptidoglykánových väzieb a tvorbe pórov v bakteriálnej bunkovej stene. Rýchly nárast tlaku v konečnom dôsledku spôsobuje osmotickú lýzu bakteriálnej bunky. Endolyzíny sú vysoko vyvinutá trieda enzýmov, ktoré sa vyznačujú rôznorodými proteínovými štruktúrami a mechanizmami účinku napriek tomu, že majú spoločnú funkciu. Avšak práve rozdiely v štruktúre bielkovinových domén im poskytujú ich špecifickosť. V závislosti od neprítomnosti alebo prítomnosti signálnej sekvencie sa endolyzíny klasifikujú ako kanonické endolyzíny (žiadna signálna sekvencia) a SAR endolyzíny (signál uvoľňujúci ukotvenie proteínu, N-koncová signálna kotva typu II). Kanonické endolyzíny sa hromadia v cytoplazme a uvoľňujú sa v presnom načasovaní cez veľké otvory generované agregáciou molekúl holínov. Holíny sú malé membránové proteíny, ktoré riadia načasovanie lýzy. Akumulujú sa v membráne hostiteľskej bunky, až kým sa v naprogramovanom čase (pravdepodobne pri dosiahnutí kritickej koncentrácie) zhlukujú do oligomérov a permeabilizujú hostiteľskú cytoplazmatickú membránu, čo spôsobí stratu polarizácie. Napríklad v takzvanom kanonickom modeli interakcie holín-endolyzín, holíny tvoria niekoľko mikrónových otvorov vo vnútornej membráne bunky, ktoré sú potrebné na to, aby endolyzíny získali prístup k peptidoglykánovej vrstve baktérií. Endolyzíny SAR sa akumulujú v neaktívnej forme a sú viazané na cytoplazmatickú membránu N-terminálnymi SAR doménami, ktoré majú hydrofóbny charakter. Tieto endolyzíny sú exportované do periplazmy nezávisle od holínu. Po depolarizácii membrány dochádza k uvoľneniu enzýmov z membrány a následne v periplazmatickom priestore prechádzajú na katalyticky aktívnu formu. Nemusia teda prechádzať veľkými otvormi v bunkovej membráne. Namiesto toho k ich uvoľneniu dochádza prostredníctvom pinholínov. Pinholíny patria do II triedy holínov. Sú to fágové lytické proteíny, ktoré vytvárajú malé póry v bakteriálnej membráne, ktoré vedú k depolarizácii membrány, spúšťajú aktiváciu SAR endolyzínu a degradáciu peptidoglykánov v celom bunkovom periplazmatickom priestore. Výsledkom tohto druhu lýzy je všeobecná lýza vonkajšej membrány hostiteľskej bunky. Kvôli svojej veľkosti sú dierky príliš malé pre transport endolyzínu, ale dostatočne veľké na prechod iónov, čo spôsobuje depolarizáciu bunkovej membrány baktérií.
Lyzíny spojené s virónom (VALs – virion asociated lysins) sú tiež známe ako peptidoglykánové hydrolázy, ktoré sa podieľajú na vstupe genetického materiálu bakteriofága do hostiteľskej bunky. Niektoré sa dokážu zmeniť v dôsledku modifikácie ich hostiteľskej bunky a sú veľmi špecifické pre daný druh alebo bakteriálny sérotyp. VAL sú štrukturálnou časťou viriónov a môžu byť lokalizované na fágovom chvoste alebo môžu byť súčasťou kapsidu. Akonáhle je fágom rozpoznaný receptor hostiteľa, konformačná zmena fága umožňuje vstup nukleovej kyseliny do baktérie vďaka lokálnej degradácii peptidoglykánu realizovanej VAL. Spôsob účinku VAL proti baktériám spočíva v rozrušení peptidoglykánovej vrstvy baktérií hydrolýzou chemických väzieb. Fágové VAL aj endolyzíny teda pôsobia na rovnakom substráte, rozdiel medzi nimi je v tom, že endolyzíny nie sú štrukturálnou súčasťou viriónov a sú prítomné v cytosóle hostiteľskej bunky počas neskorého štádia lytického cyklu, kedy po ich nahromadení hydrolyzujú peptidoglykán v bakteriálnej bunkovej stene zvnútra, čím sa uvoľní zrelé fágové potomstvo. Na rozdiel od VAL prirodzene pôsobiacich zvonku bakteriálnej bunky, musia teda endolyzíny najskôr prejsť cez bunkovú membránu, aby dosiahli bunkovú stenu a spôsobili lýzu. Keď sa lyzíny používajú ako rekombinantné enzýmy a aplikujú sa exogénne, spôsobujú rýchlu lýzu. Je to silná schopnosť rýchlo lyzovať patogénne grampozitívne bunky po priamom kontakte s peptidoglykánom tzv. „lýzou zvonku“, ktorá položila základ pre využitie lyzínov ako nových silných antibakteriálnych látok. V prípade gramnegatívnych baktérií vonkajšia membrána bráni prístupu exogénnych lyzínov k peptidoglykánu bunkovej steny a preto je ich využitie ako potenciálnych antimikrobiálnych látok obmedzené. Na rozdiel od antibiotík, lyzíny možno použiť na selektívne zacielenie sa na špecifické patogénne baktérie bez ovplyvnenia okolitej komenzálnej mikrobioty pretože majú úzky rozsah hostiteľov čo ich robí všeobecne buď druhovo alebo rodovo špecifickými. Vysoká špecifickosť lyzínov znižuje pravdepodobnosť vzniku bakteriálnej rezistencie, čím sa rezistencia stáva zriedkavým javom.
Polysacharidové depolymerázy sú veľmi užitočné vďaka ich schopnosti dezintegrovať bakteriálne kapsulárne polysacharidy (CPS) a extracelulárne polysacharidy (EPS) tvoriace matricu biofilmov, ktoré sú pre bakteriálne bunky významnou ochrannou bariérou. Depolymerázy, ktoré sú štrukturálnou súčasťou fágovej častice, podporujú penetráciu fága do biofilmu a prístup k bunkovej stene hostiteľských baktérií. Biochemicky sú rozdelené do dvoch skupín, lyázy a hydrolázy. Na rozdiel od hydroláz, lyázy štiepia substráty nehydrolyticky, to znamená, že po rozštiepení substrátu sa neuvoľní žiadna molekula vody. Lyázy predstavujú väčšinu doposiaľ charakterizovaných depolymeráz kódovaných fágmi. Vo všeobecnosti sa vyznačujú veľkou rozmanitosťou v substrátovej špecifickosti. Môže sa však stať, že konkrétne miesto štiepenia je prítomné v rôznych typoch polysacharidov, čím sa enzýmu umožní pôsobiť na dvoch rôznych substrátoch. Tieto enzýmy patria k nepriamym spôsobom, ako sa vysporiadať s baktériami, pretože pôsobia na zapúzdrené baktérie oslabením ich polymérnej štruktúry, ktorá tvorí kapsulu. Tento proces pomáha znižovať bakteriálnu virulenciu tým, že umožňuje imunitnému systému vykonávať svoju činnosť – rozpoznávať odhalené povrchové receptory patogénov a vďaka tomu zahájiť imunitnú odpoveď. Vzhľadom na to, že termín depolymeráza môže označovať akýkoľvek proteín, ktorý je schopný degradovať polyméry, bolo by možné považovať za depolymerázy aj fágmi kódované endolyzíny, pretože štiepia peptidoglykán, bakteriálny polysacharid hydrolázovým spôsobom. Obvykle sú však pod týmto pojmom myslené fágové depolymerázy degradujúce EPS, CPS a lipopolysacharidy (LPS). Jednou zaujímavou vlastnosťou depolymeráz je ich široký bakteriálny rozsah. Na rozdiel od lyzínov sa môže objaviť rezistencia voči fágovým depolymerázam v dôsledku modifikácií v polysacharidovom zložení kapsuly, exopolysacharidov alebo lipopolysacharidov.
Proteíny viažuce receptory (RBP) bakteriofágov iniciujú infekciu ich zodpovedajúceho bakteriálneho hostiteľa tým, že pôsobia ako primárny determinant pre špecifickosť hostiteľa. RBP sa v počiatočnom kroku fágovej infekcie podieľajú na adsorpcii fága špecifickou väzbou na receptory na povrchu hostiteľských baktérií, ako sú proteíny, polysacharidy, LPS a sacharidové skupiny. Zatiaľ čo bežnými receptormi pre fágov gramnegatívnych baktérií sú LPS, CPS alebo proteíny (poríny a transportné proteíny), v prípade fágov grampozitívnych baktérií sú to najčastejšie peptidoglykán, teichoové kyseliny, alebo exponované polysacharidy. RBP môžu byť klasifikované ako chvostové vlákna (TF) alebo chvostové hroty (TSP). Morfologicky sú oba typy zložené z homotrimérnych komplexov, pričom TF tvoria dlhé reťazce, ktoré interagujú s proteínovými a/alebo sacharidovými receptormi a nevykazujú enzymatickú aktivitu, a TSP tvoria viac globulárne komplexy s centrálnou doménou s enzymatickou aktivitou voči sacharidovým skupinám na povrchu baktérií. RBP ponúkajú niekoľko výhod v porovnaní s inými rozpoznávacími prvkami ako sú protilátky, napríklad porovnateľnú alebo vyššiu špecifickosť, vysokú citlivosť, ľahkú genetickú modifikáciu, nízke náklady, malé rozmery a vysokú chemickú a fyzikálnu odolnosť. Preto sa v posledných rokoch objavilo niekoľko úspešných aplikácií RBP na detekciu baktérií, najmä v kombinácii s biosenzormi, spektrofotometriou alebo s využitím ELISA.
Fagová terapia
Myšlienka použitia bakteriofágov na liečbu infekčných chorôb sa datuje na začiatok 20. storočia a existuje už takmer storočie ako každá sľubná alternatívna liečebná metóda. Bakteriofágy existovali dlho pred objavením penicilínu. Medzi rokmi 1920 a 1940 boli bakteriofágy komerčne dostupné a používané v niekoľkých krajinách na liečbu infekčných chorôb (cholera, infekcie dýchacích ciest, úplavica a mnohé iné choroby). Avšak účinnosť tohto biomateriálu bola spochybnená z niekoľkých dôvodov: neschopnosť reprodukovať výsledky, nedostatočné informácie o fágových titroch, kontrolných skupinách a rozsahu hostiteľov. Navyše väčšina vedcov bola skeptická voči fágovej terapii proti infekčným chorobám. Keď bol objavený penicilín a iné ATB okolo roku 1940, fágová terapia bola potlačená do úzadia. Avšak, vznik liekovej rezistencie, nedostupnosť nových liekov na zmiernenia ich šírenia, a hľadanie nových riešení viedli k znovuzrodeniu fágovej terapie. V priebehu rokov sme sa veľa naučili o genetike a rozmanitosti bakteriofágov. Tiež došlo k významnému pokroku vo vývoji prístupov molekulárnej biológie pre štúdium bakteriofágov a ich interakcií s bunkami ľudského tela. Fágové koktaily sa teda v súčasnosti využívajú na liečbu niekoľkých infekčných chorôb. Väčšina krajín však stále vidí fágovú terapiu ako experimentálnu liečbu. Je to spôsobené nedostatočnou reguláciou, bezpečnosťou a chýbajúcou štandardnou metódou prípravy. Napríklad v USA je súčasná aplikácia fágovej terapie povolená pri dekontaminácii potravín a povrchov, hospodárskych zvierat a produktov na rastlinnej báze. FDA schválila komerčné fágové prípravky proti bežným bakteriálnym patogénom, ako je Listeria monocytogenes a Salmonella spp. na ošetrenie hotového jedla. V Rusku a Gruzínsku sú dostupné produkty na báze fágov využívané na liečbu tých bakteriálnych infekcií, ktoré nereagovali na konvenčnú liečbu. Niekoľko produktov na báze fágov, ktoré prešli klinickými testami, sa dokonca využíva na liečbu týfusu, ušných infekcií a infekcie rán. Okrem toho mnohé ďalšie klinické štúdie zaznamenali pozitívny účinok fágov na zvieracích modeloch. Nedávny pokrok v oblasti fágovej terapie je schválenie nového Centra pre inovatívne fágové aplikácie a terapeutiká (IPATH) od Úradu pre potraviny a liečivá (FDA). Nedávno bola tiež schválená prvá klinická štúdia s intravenóznym použitím fágovej terapie v USA. Okrem toho neustále prebiehajú rôzne in vivo a in vitro štúdie testovania potenciálnych schopností fágov a ich využitia ako alternatívnych liečiv. Napriek možnosti nahradenia antibiotík fágmi, pre určité typy bakteriálnych patogénov existuje aj stredná cesta, ktorá uznáva potenciál fágov, ale aj to, že antibiotiká by sa nemali prestať používať. V mnohých situáciách má kombinované použitie fágov s antibiotikami väčší úspech ako ich jednotlivé použitie a to z hľadiska úspešnosti liečby aj v obmedzení vývoja rezistencie.
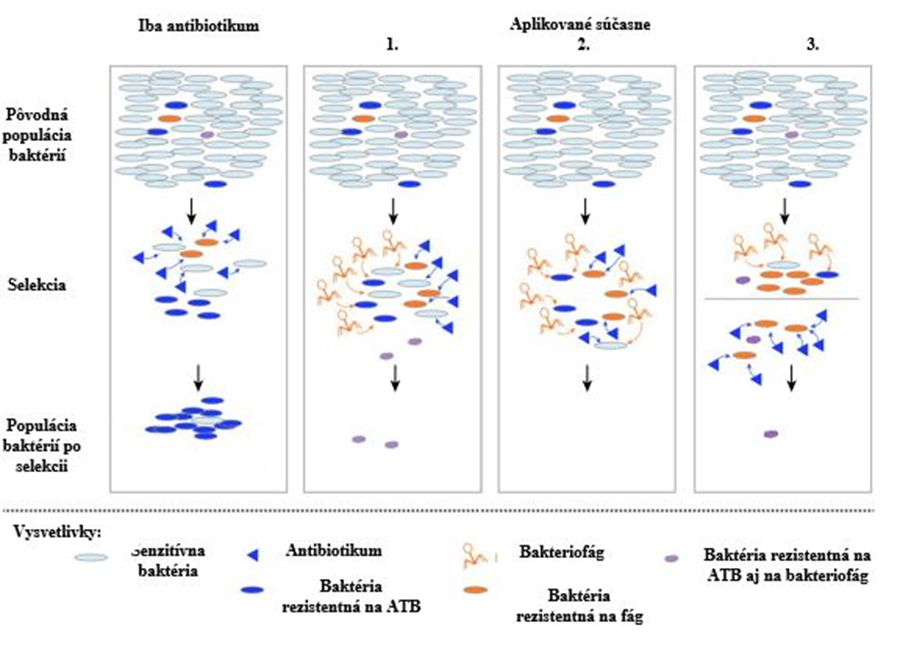
Využitie synergie ako stratégie na zvýšenie účinku antibiotík
Niektoré bakteriofágy vykazujú synergickú aktivitu pri liečbe infekcií v kombinácii s antibiotikami (ATB) a inými biomateriálmi. Logika kombinovania fágov a antibiotík vychádza z evolučného chápania, kde dva dostatočne odlišné selektívne tlaky budú pravdepodobne účinnejšie ako jeden z nich, napríklad antibiotiká samostatne. Hoci si baktérie môžu tiež vyvinúť rezistenciu voči fágom, je pre baktérie oveľa ťažšie vyvinúť rezistenciu na antibiotiká a bakteriofágy súčasne. Interakcie medzi stresormi (ATB alebo fág) sú aditívne, antagonistické a synergické, kde kombinovaný účinok je súčet, menší ako súčet alebo väčší než súčet jednotlivých účinkov antimikrobiálnych látok ako fágov alebo antibiotík (Obrázok 2).

V súčasnosti existuje množstvo príkladov pozitívnych interakcií medzi antibiotikami a fágmi pri kontrole bakteriálnych patogénov in vitro aj in vivo. Napríklad fágy v kombinácii s antibiotikami môžu eradikovať kmene Klebsiella pneumoniae, ktoré tvoria biofilm a zastaviť vznik rezistentných variantov in vitro; tieto kombinácie tiež dokázali zabrániť infekcii u diabetických myší spôsobených Staphylococcus aureus rezistentným na meticilín (MRSA) a úplne ochránili brojlerové kurčatá pred infekciami spôsobenými Escherichia coli. V týchto prípadoch a ďalších, kombinovaná liečba lytického fága s antibiotikom viedla nielen k lepšej kontrole alebo eradikácii baktérií, ale k úplnej prevencii vzniku rezistentných variant baktérií v porovnaní s jednotlivo používanými antimikrobiálnymi látkami. Ciprofloxacín (CIP) má maximálny synergický účinok s fágom PEV20 proti dvom klinickým kmeňom P. aeruginosa. Citlivosť P. aeruginosa na kombinovanú liečbu bola pripísaná inhibícii DNA gyrázovej aktivite v bakteriálnej bunke ciprofloxacínom a zosilneniu efluxnej pumpy pomocou fága PEV20. Antimikrobiálne látky (obsahujúce rodiny polypeptidov) ako napr. bacitracín, kolistín A, kolistín B, polymyxín B1 a polymyxín B2 sa tiež používajú v kombinovanej terapii s fágmi na liečbu multirezistentných patogénov. Uvádza sa, že majú synergickú aktivitu proti multirezistentným patogénom, ako napr. P. aeruginosa, K. pneumonia a A. baumannii. Napríklad antibiotikum amikacín degraduje biofilm P. aeruginosa v synergii s bakteriofágom a taktiež synergická aktivita fágu s antibiotikami ako sú meropenem (MER), gentamycín (GEN) a ciprofloxacín (CIP) ukázala, že samotný fág môže znížiť tvorbu biofilmu spôsobeného A. baumannii. Kombinácia CIP alebo MER s fágom však prejavila viac lytickej aktivity voči baktériám ako kombinácia s GEN. Kombinácia fágov a antibiotík má výhody, ako sú: ich vyššia schopnosť zosilnenia in situ účinkov, obmedzené spektrum hostiteľov (v dôsledku toho je napr. minimalizovaný dopad na mikrobióm), hypoteticky neobmedzený počet dostupných fágov ako alternatívy v prípade zlyhania určitých fágov a zostavenie špecifických fágových koktailov pre každý špecifický bakteriálny patogén. Fágové koktaily, koktaily antibiotík a navrhnutých fágov môžu znížiť rozvoj rezistencie. Stručne povedané, ak sa dve antimikrobiálne látky zameriavajú na rôzne bunkové procesy a zahŕňajú rôzne mechanizmy rezistencie, môžu pôsobiť synergicky a znižovať množstvo baktérií a limitovať tak vznik rezistencie voči jednému z činiteľov.
Ideálny bakteriofág a génové inžinierstvo
Z pohľadu využitia fágov v humánnej medicíne alebo v iných odvetviach, napríklad potravinárstve, by mal mať ideálny fág nasledovné vlastnosti: 1) dostatočne široký, avšak druhovo obmedzený rozsah hostiteľov, aby sa zameral iba na relevantné patogény, pri zachovaní komenzálnej mikrobioty; 2) kompatibilitu s jednoduchou sprievodnou diagnostikou na rýchle stanovenie citlivosti bakteriálnych patogénov voči fágom; 3) silnú antibakteriálnu účinnosť na eradikáciu záťaže patogénmi a 4) priaznivú interakciu s imunitným systémom cicavcov a s ktorýmkoľvek z nich minimálnu imunogenicitu, aby sa zabránilo indukcii nežiaducej imunitnej odpovede, alebo s adjuvantnou kapacitou na posilnenie imunitných reakcií. Celkovo sa tieto aspekty definujú ako štyri piliere fágovej terapie (Obrázok 4).
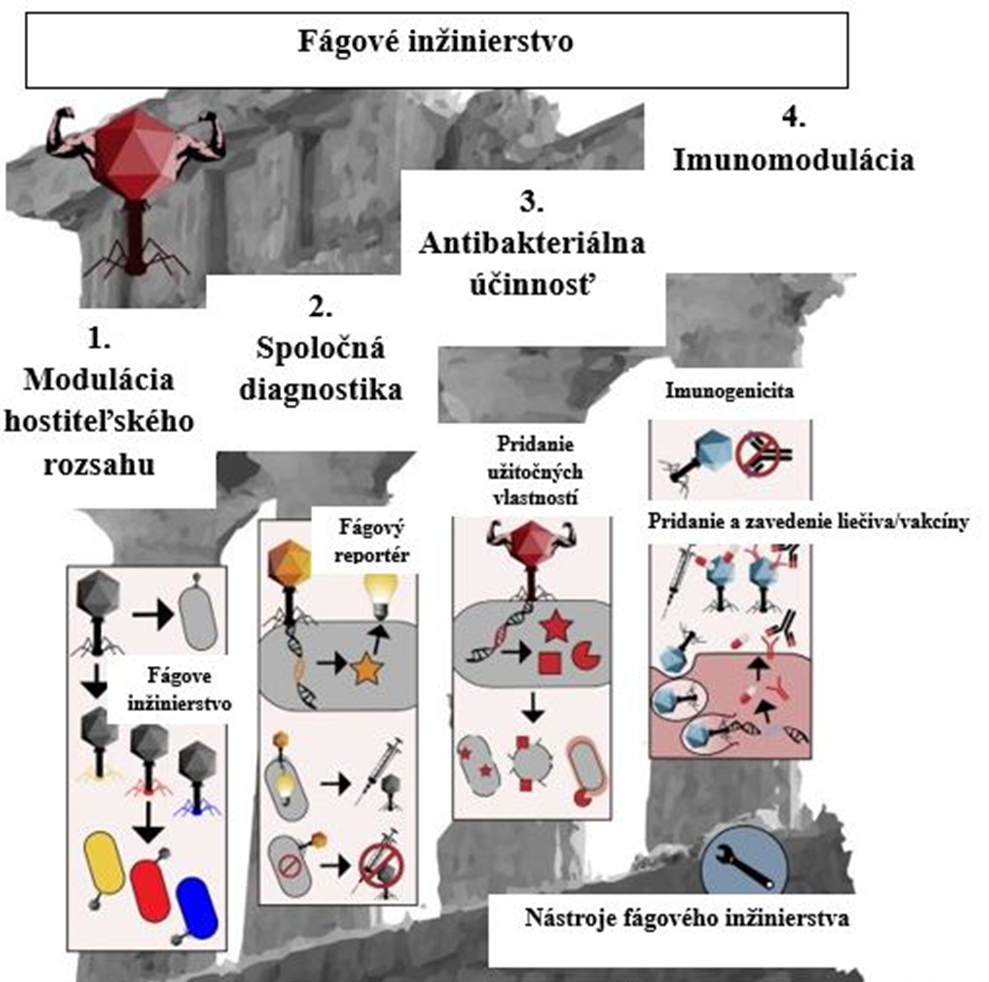
Avšak aj napriek mnohým úspešným prípadom využitia fágov v terapii, dosiahnuté výsledky boli často neuspokojivé a to čiastočne kvôli obmedzenému pokrytiu a účinnosti prirodzených fágov, ich nepredvídateľným interakciám s imunitným systémom cicavcov a neschopnosti začať liečbu prispôsobenú danej osobe v kontexte klinického skúšania. V posledných rokoch sa dosiahol výrazný pokrok a rozšírenie súboru nástrojov pre fágové inžinierstvo a načrtávajú sa princípy pre návrh umelých fágov s požadovanými vlastnosťami. Množstvo umelých fágov bolo vytvorených v snahe prekonať inherentné terapeutické obmedzenia prirodzených fágov. S využitím najmodernejších techník úpravy genómu, ako je rekombinácia, CRISPR-Cas-asistovaná selekcia alebo syntetické zostavenie genómu in vitro, však môžu byť špecifické gény alebo klastre génov vo fágovom genóme presne navrhnuté tak, aby umožňovali začlenenie, vymazanie, modifikáciu alebo diverzifikáciu užívateľom definovaných funkcií. Môžu to byť napríklad receptor viažuce proteíny vymieňané medzi rôznymi fágmi, aby sa adaptovali alebo expandovali rozsah hostiteľov. Do fágov môžu byť začlenené gény kódujúce heterológne antimikrobiálne efektory, aby poskytli sekundárne antibakteriálne účinky a zlepšili účinnosť fágov, ďalej gény zodpovedné za lýzu hostiteľskej bunky (napríklad holín-endolyzín systémy) možno odstrániť, aby sa vytvoril variant nelytického fága, ktorý zabíja svojich hostiteľov s minimalizovaným uvoľňovaním endotoxínov aby sa zabránilo aktivácii poškodzujúcich zápalových reakcií. Reportérové gény, ako sú luciferázy, môžu byť integrované do fágových genómov, aby sa umožnila rýchla, citlivá a priama detekcia cieľových baktérií v klinicky relevantných matriciach. Tieto reportérove fágy by boli vhodné ako sprievodná diagnostika na hodnotenie profilov fágov a citlivosti klinických kmeňov a umožňovali by tak obozretný výber fágov na personalizovanú liečbu. Použitie na mieru navrhnutých, skonštruovaných fágov bude určite nevyhnutné na urýchlenie fágovej terapie prostredníctvom klinických skúšok a mohlo by sa stať konvenčným spôsobom liečby bakteriálnych infekcií. Napriek tomu, len veľmi málo z týchto upravených fágov sa doteraz použilo v klinických podmienkach alebo boli testované na klinických kmeňoch.
Záver
Pre takmer všetky využívané antibiotiká sa v súčasnosti objavujú multirezistentné baktérie. Antibiotiká sú stabilné molekuly, ktoré vyvíjajú selektívny tlak, ktorý umožňuje vývoj baktérií, aby mohli uniknúť, a preto by sa mali navrhnúť nové spôsoby liečby. Bakteriofágy sú skutočným alternatívnym riešením tohto problému. Fágy majú rôzne potenciálne aplikácie, počnúc ich použitím vo fágovej terapii po využitie enzýmov fágového pôvodu. Fágová terapia sa používa takmer storočie a vyzerá ako bezpečná a účinná liečba, aj keď je potrebné vykonať ďalšie štúdie a výskumy, aby sa zaručila jej bezpečnosť z krátkodobého aj dlhodobého hľadiska. Objavujú sa veľmi zaujímavé a užitočné varianty fágovej terapie na zlepšenie fágových funkcií a na ich využitie v mnohých oblastiach. Veľké množstvo možností vďaka veľkej rozmanitosti fágov, použitie fágových koktailov alebo ich kombinácia s antibiotikami umožňujú zvoliť najvhodnejší prístup pre každý scenár a otvoriť nové oblasti výskumu na určenie jeho výhod a nevýhod. Prekvapivo existuje aj mnoho nových aplikácií odvodených od fágovej terapie, z ktorých môžu profitovať aj iné oblasti. Fágy sa javia ako skvelé riešenie nielen ako alternatívna liečba proti bakteriálnym ochoreniam (fágová terapia alebo použitie enzýmov odvodených z fágov), ale aj ako zaujímavé nástroje v prevencii a diagnostike (detekcia a typizácia baktérií). Synergia pozorovaná medzi antibiotikami a fágmi je všeobecným javom opísaným v mnohých štúdiách, ale ešte nie je dostatočne pochopená a vyvinutá na to, aby dosiahla skutočnú aplikáciu. Preto potrebujeme hlbšie pochopenie molekulárneho základu pre kombinovanú liečbu antibiotikami a fágmi. Napriek tomu však máme druhú šancu na kontrolu bakteriálnych infekcií, no musíme sa vyvarovať rovnakých chýb ako pri nekontrolovateľnom užívaní antibiotík. Napriek tomu, že fágová terapia vykazuje úspech v rôznych jednotlivých prípadoch, stále je potrebné dokázať jej komplexný terapeutický potenciál.
Použitá literatúra
Anyaegbunam, N. J., Anekpo, C. C., Anyaegbunam, Z. K. G., Doowuese, Y., Chinaka, C. B., Odo, O. J., … & Mba, I. E. (2022). The resurgence of phage-based therapy in the era of increasing antibiotic resistance: From research progress to challenges and prospects. Microbiological research, 127155. https://doi.org/10.1016/j.micres.2022.127155
Azeredo, J., García, P., & Drulis-Kawa, Z. (2021). Targeting biofilms using phages and their enzymes. Current Opinion in Biotechnology, 68, 251-261. https://doi.org/10.1016/j.copbio.2021.02.002
Barceló, C., & Hochberg, M. E. (2016). Evolutionary rationale for phages as complements of antibiotics. Trends in microbiology, 24(4), 249-256. http://dx.doi.org/10.1016/j.tim.2015.12.011
Boeckaerts, D., Stock, M., De Baets, B., & Briers, Y. (2022). Identification of Phage Receptor-Binding Protein Sequences with Hidden Markov Models and an Extreme Gradient Boosting Classifier. Viruses, 14(6), 1329. https://doi.org/10.3390/v14061329
Costa, S. P., Cunha, A. P., Freitas, P. P., & Carvalho, C. M. (2022). A phage receptor-binding protein as a promising tool for the detection of Escherichia coli in human specimens. Frontiers in microbiology, 13. https://doi.org/10.3389/fmicb.2022.871855
Domingo-Calap, P., & Delgado-Martínez, J. (2018). Bacteriophages: protagonists of a post-antibiotic era. Antibiotics, 7(3), 66. http://dx.doi.org/10.3390/antibiotics7030066
Fenton, M., McAuliffe, O., O’Mahony, J., & Coffey, A. (2010). Recombinant bacteriophage lysins as antibacterials. Bioengineered bugs, 1(1), 9-16. https://doi.org/10.4161/bbug.1.1.9818
Gonzalez, F., & Scharf, B. E. (2021). Identification of Receptor Binding Proteins in Flagellotropic Agrobacterium Phage 7-7-1. Viruses, 13(7), 1267. https://doi.org/10.3390/v13071267
Grabowski, Ł., Łepek, K., Stasiłojć, M., Kosznik-Kwaśnicka, K., Zdrojewska, K., Maciąg-Dorszyńska, M., … & Węgrzyn, A. (2021). Bacteriophage-encoded enzymes destroying bacterial cell membranes and walls, and their potential use as antimicrobial agents. Microbiological Research, 248, 126746. https://doi.org/10.1016/j.micres.2021.126746
Chaudhry, W. N., Concepcion-Acevedo, J., Park, T., Andleeb, S., Bull, J. J., & Levin, B. R. (2017). Synergy and order effects of antibiotics and phages in killing Pseudomonas aeruginosa biofilms. PloS one, 12(1), e0168615. https://doi.org/10.1371/journal.pone.0168615
Knecht, L. E., Veljkovic, M., & Fieseler, L. (2020). Diversity and function of phage encoded depolymerases. Frontiers in Microbiology, 10, 2949. https://doi.org/10.3389/fmicb.2019.02949
Latka, A., Maciejewska, B., Majkowska-Skrobek, G., Briers, Y., & Drulis-Kawa, Z. (2017). Bacteriophage-encoded virion-associated enzymes to overcome the carbohydrate barriers during the infection process. Applied microbiology and biotechnology, 101(8), 3103-3119. https://doi.org/10.1007/s00253-017-8224-6
Li, M., Wang, H., Chen, L., Guo, G., Li, P., Ma, J., … & Zhang, W. (2022). Identification of a phage-derived depolymerase specific for KL47 capsule of Klebsiella pneumoniae and its therapeutic potential in mice. Virologica Sinica. https://doi.org/10.1016/j.virs.2022.04.005
Li, X., He, Y., Wang, Z., Wei, J., Hu, T., Si, J., … & Teng, T. (2021). A combination therapy of Phages and Antibiotics: Two is better than one. International Journal of Biological Sciences, 17(13), 3573. https://doi.org/10.7150/ijbs.60551
Lopes, A., Pereira, C., & Almeida, A. (2018). Sequential combined effect of phages and antibiotics on the inactivation of Escherichia coli. Microorganisms, 6(4), 125. http://dx.doi.org/10.3390/microorganisms6040125
Meile, S., Du, J., Dunne, M., Kilcher, S., & Loessner, M. J. (2022). Engineering therapeutic phages for enhanced antibacterial efficacy. Current opinion in virology, 52, 182-191. https://doi.org/10.1016/j.coviro.2021.12.003
Oliveira, H., Melo, L. D., & Santos, S. B. (2019). Bacteriophage proteins as antimicrobials to combat antibiotic resistance. Antibiotic Drug Resistance, 343-406. https://doi.org/10.1002/9781119282549.ch15
Roach, D. R., Khatibi, P. A., Bischoff, K. M., Hughes, S. R., & Donovan, D. M. (2013). Bacteriophage-encoded lytic enzymes control growth of contaminating Lactobacillus found in fuel ethanol fermentations. Biotechnology for biofuels, 6(1), 1-11. https://doi.org/10.1186/1754-6834-6-20
Rousset, F., Depardieu, F., Miele, S., Dowding, J., Laval, A. L., Lieberman, E., … & Bikard, D. (2022). Phages and their satellites encode hotspots of antiviral systems. Cell host & microbe, 30(5), 740-753. https://doi.org/10.1016/j.chom.2022.02.018
Tagliaferri, T. L., Jansen, M., & Horz, H. P. (2019). Fighting pathogenic bacteria on two fronts: phages and antibiotics as combined strategy. Frontiers in cellular and infection microbiology, 9, 22. https://doi.org/10.3389/fcimb.2019.00022
V. Volozhantsev, N., M. Shpirt, A., I. Borzilov, A., V. Komisarova, E., M. Krasilnikova, V., S. Shashkov, A., … & A. Knirel, Y. (2020). Characterization and therapeutic potential of bacteriophage-encoded polysaccharide depolymerases with β galactosidase activity against Klebsiella pneumoniae K57 capsular type. Antibiotics, 9(11), 732. http://dx.doi.org/10.3390/antibiotics9110732
Volozhantsev, N. V., Borzilov, A. I., Shpirt, A. M., Krasilnikova, V. M., Verevkin, V. V., Denisenko, E. A., … & Dyatlov, I. A. (2022). Comparison of the therapeutic potential of bacteriophage KpV74 and phage-derived depolymerase (β-glucosidase) against Klebsiella pneumoniae capsular type K2. Virus Research, 322, 198951. https://doi.org/10.1016/j.virusres.2022.198951 Wu, Y., Wang, R., Xu, M., Liu, Y., Zhu, X., Qiu, J., … &
Li, Q. (2019). A novel polysaccharide depolymerase encoded by the phage SH-KP152226 confers specific activity against multidrug-resistant Klebsiella pneumoniae via biofilm degradation. Frontiers in microbiology, 10, 2768. https://doi.org/10.3389/fmicb.2019.02768

Leave a Reply