Veronika Vojčíková1, Miroslava Hlebová1, Lukáš Hleba2
1Univerzita Svätého Cyrila a Metoda v Trnave, Fakulta prírodných vied
2Slovenská poľnohospodárska univerzita v Nitre, Fakulta biotechnológie a potravinárstva
Charakteristika aflatoxínov a význam ich prítomnosti v potravinách
Aflatoxíny sú sekundárne toxické metabolity produkované mikroskopickými vláknitými hubami, najmä druhmi Aspergillus flavus, A. parasiticus alebo A. nomius. K ich produkcii dochádza prevažne vo vlhkých a teplých podmienkach, pričom kontaminujú širokú škálu poľnohospodárskych komodít ako sú arašidy, kukurica, obilniny, ryža a mnohé ďalšie. Ku kontaminácii plodín aflatoxínmi dochádza prevažne po zbere úrody, počas nepriaznivých skladovacích podmienok. Doteraz bolo popísaných približne 20 aflatoxínov, pričom AFB1, AFB2, AFG1 a AFG2, sú z hľadiska toxicity a distribúcie v potravinárskych komoditách najvýznamnejšie. Všetky tieto zlúčeniny pôsobia ako silné karcinogény a preto boli Medzinárodnou agentúrou pre výskum rakoviny, zaradené do skupiny 1 „karcinogénne pre ľudí“. Okrem iného patria aflatoxíny medzi teratogény a majú cytotoxický, imunosupresívny, nefrotoxický a génotoxický účinok. Najväčšia pozornosť, je venovaná práve AFB1, ktorého toxický charakter je spôsobený prítomnosťou laktónového a difuranového kruhu. Okrem negatívneho vplyvu aflatoxínov na zdravie ľudí a zvierat, sú s aflatoxínovou kontamináciou spájané aj vysoké ekonomické straty v poľnohospodárstve. Odhaduje sa, že práve kvôli mykotoxínom, ku ktorým aflatoxíny patria, dochádza každoročne ku strate 25 % svetových zásob poľnohospodárskych produktov. Práve z tohto dôvodu bolo potrebné vyvinúť určité metódy odstraňovania aflatoxínov z potravín.
Metódy eliminácie aflatoxínov v potravinách
Nakoľko aflatoxíny predstavujú značné zdravotné riziká a spôsobujú obrovské ekonomické straty v poľnohospodárstve a potravinárstve, boli vytvorené rôzne metódy ich eliminácie. Pokusy o odstraňovanie aflatoxínov z potravinárskych komodít, sú však značne obmedzené. Je to spôsobené práve štruktúrou aflatoxínov, ktoré sú nebielkovinovej povahy a odolávajú vysokým teplotám, nízkym hodnotám pH a mnohým ďalším environmentálnym faktorom. V súčasnosti existuje množstvo rôznych metód eliminácie aflatoxínov, pričom k tým hlavným patria:
- fyzikálne metódy eliminácie
- chemické metódy eliminácie
- biologické metódy eliminácie.
V posledných rokoch bola preferovaná najmä aplikácia fyzikálnych metód ako je mechanické triedenie, vplyv vysokých teplôt alebo žiarenia. Po nich boli vyvinuté chemické metódy eliminácie, ktoré zahŕňajú aplikáciu organických a anorganických kyselín, oxidačných činidiel, zásad a mnohých ďalších. K nevýhodám týchto eliminačných metód však patrí pomerne nízka účinnosť a negatívny dopad na senzorické a nutričné vlastnosti potravín. Z tohto dôvodu bolo potrebné vyvinúť nové, ale najmä účinnejšie spôsoby eliminácie aflatoxínov. V tejto súvislosti, sa ako zaujímavé riešenie javí práve biologická eliminácia aflatoxínov, s využitím rôznych mikroorganizmov alebo ich sekundárnych metabolitov. Širokú aplikáciu v odstraňovaní aflatoxínov z potravín a krmív predstavujú napríklad kvasinky, ktoré majú oproti baktériám a mikroskopickým vláknitým hubám výhodu v tom, že neprodukujú žiadne iné toxické metabolity pre človeka alebo zvieratá. K ďalším výhodám aplikácie kvasiniek, patrí aj vysoká účinnosť dekontaminácie, minimálny dopad na životné prostredie a nízke náklady spájané s ich použitím. Princíp ich aplikácie spočíva buď v prevencii produkcie aflatoxínov, prostredníctvom aplikácie biokontrolných kvasiniek alebo ich sekundárnych metabolitov – „killer toxínov“ a prchavých organických zlúčenín. Ich účinok spočíva v inhibícii rastu mikroskopickej vláknitej huby alebo v inhibícii produkcie mykotoxínu mikroskopickou vláknitou hubou. Ďalšou možnosťou aplikácie kvasiniek je biodegradácia aflatoxínov, za vzniku menej toxických alebo netoxických produktov. V tomto procese zohrávajú hlavnú úlohu predovšetkým intracelulárne alebo extracelulárne metabolity kvasiniek ako sú enzýmy. Inou možnosťou je aj aplikácia kvasiniek ako tzv. bioadsorbentov, schopných viazať aflatoxíny z prostredia, na základe unikátnej štruktúry ich bunkovej steny.
Prchavé organické zlúčeniny ako nástroj biokontroly
Pri kontrole fungálnych patogénov a ich mykotoxínov, sa používajú rôzne biokontrolné kvasinky alebo ich sekundárne metabolity. Mnohé kvasinky napríklad dokážu produkovať prchavé organické zlúčeniny (Volatile organic compounds – VOCs), ktoré možno použiť ako biokontrolné činidlá proti aflatoxigénnym hubám a ich mykotoxínom. Prchavé organické zlúčeniny, sú zlúčeniny na báze uhlíka, s nízkou molekulovou hmotnosťou, ktoré sa vďaka svojej povahe jednoducho šíria v prostredí. Zaradujeme k nim rôzne zlúčeniny, vrátane kyselín, esterov (etylpropionát, n – propylacetát, izolbutylacetát, 2 – izobutylacetát, 2 – fenylacetát), ketónov (heptán – 2 – ón, acetylbenzén), aromatických zlúčenín, alkoholov (2 – fenyletanol, benzylalkohol), uhľovodíkova iných. Ich význam spočíva práve v biologickej kontrole fytopatogénov ako sú aj aflatoxinogénne mikroskopické vláknité huby a ich mykotoxíny. Významný antifungálny a antiaflatoxinogénny vplyv majú napríklad prchavé organické zlúčeniny produkované kvasinkou druhu Saccharomyces cerevisiae NJ – 1, ktoré ako hlavnú prchavú organickú látku, produkujú 3 – metyl – 1 – butanol. Táto zlúčenina dokáže účinne inhibovať rast aj sporuláciu mikroskopickej vláknitej huby rodu Aspergillus flavus, už po 6 hodinách spoločnej kultivácie. Okrem iného, sú tieto prchavé organické zlúčeniny, schopné účinne inhibovať expresiu génu zodpovedného za produkciu aflatoxínu B1.
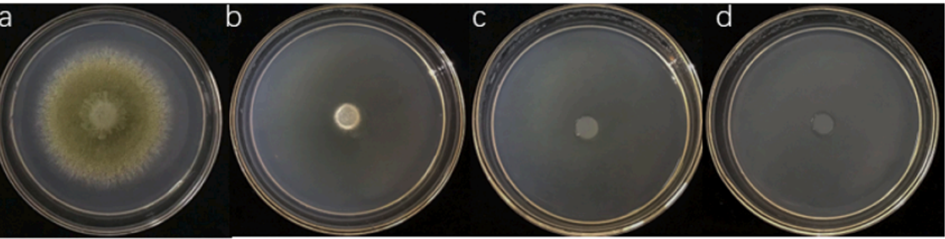
Obrázok 1: Vplyv prchavých organických zlúčenín, produkovaných kvasinkou druhu S.cerevisiaeNJ – 1, na rast mycélia a sporuláciu mikroskopickej vláknitej huby druhu A. flavus po a – 0, b – 4, c – 8, d – 12 hodinách (zdroj: Yang et al., 2023).
Medzi iné významné prchavé organické zlúčeniny, produkované kvasinkami, patrí aj 2 – fenyletanol, ktorý dokáže znižovať koncentráciu AFB1, AFB2, AFG1 a AFG2 v rozmedzí od 56 – 100 %. Mechanizmus účinku 2 – fenyletanolu spočíva v inhibícii klíčenia spór a rastu mikroskopickej vláknitej huby druhu A. flavus a inhibícii expresie génov hdaA a rpdA z A. flavus, čím dochádza aj k potlačeniu syntézy aflatoxínov. Kvasinka druhu Kwoniella heveanensis DMKU – CE82, dokáže produkovať 4 rôzne typy prchavých organických zlúčenín, ktoré priamo inhibujú rast mikroskopickej vláknitej huby druhu A. flavus a tiež inhibujú aj produkciu AFB1 v zrnách kukurice. Najväčší podiel prchavých organických zlúčenín s antagonistickým účinkom dokázala kvasinka vyprodukovať v teplotnom rozmedzí 30 – 35 °C, pri 98 % relatívnej vlhkosti vzduchu. Kvasinka produkuje celkovo 4 hlavné prchavé organické zlúčeniny – kyselina izovalerová, 2 – metyl – 1 – butanol, 3 – metyl – 1 – butanol a 1,1 – dimetylhydrazín. Všetky testované prchavé organické zlúčeniny produkované kvasinkou dokážu znížiť produkciu AFB1 v závislosti od rôznych nastavení teploty a vlhkosti v rozmedzí od 76 – 85 %. Taktiež dokážu potlačiť rast a sporuláciu mycélia mikroskopickej vláknitej huby druhu A. flavus. K ďalším prchavým organickým zlúčeninám, ktoré majú antifungálny, antisporulačný a antiaflatoxinogénny charakter patria tiež acetaldehyd, etylacetát, 1 – propanol, 2 – metyl – 1 – propanol, kyselina octová, a iné. Pričom väčšina prchavých organických zlúčenín pracuje synergicky.
Kvasinkové „Killer toxíny“
K iným zaujímavým metabolitom, ktoré kvasinky dokážu produkovať určite patria aj tzv. „killer toxíny“. Z hľadiska chemickej štruktúry sa jedná o proteíny, ktoré sú schopné rozpoznávať a viazať sa na špecifické receptory cieľovej bunky a následne ju usmrtiť. V dnešnej dobe je popísaných približne 100 rôznych druhov „killer“ kvasiniek, ako sú napríklad Saccharomyces cerevisiae, Pichia anomala, Pichia membranifaciens, Kluyveromyces lactis, Metschnikowia pulcherrima. Zaujímavé je, že killer toxíny produkované kvasinkami je možné aplikovať nie len v biokontrole rastlinných patogénov alebo mykotoxínov, ale aj v humánnej terapii. Aj napriek širokým možnostiam ich aplikácie, je v dnešnej dobe väčšina killer toxínov a mechanizmus ich pôsobenia pomerne neprebádanou oblasťou. Medzi najvýznamnejšie kvasinkové killer toxíny vzhľadom na ich genetické, biochemické
vlastnosti a účinnosť sú K1, K2 a K28, produkované Saccharomyces cerevisiae, PMKT a PMKT2 z Pichia membranifaciens, zymocín z Kluyveromyces lactis, PaKT z Wickerhamomyces anomalus, Kpkt z Tetrapisispora phaffii a HM – 1 z Cyberlindnera mrakii. Okrem inhibície rastu aflatoxinogénnych mikroskopických húb, dokážu spomínane killer toxíny inhibovať aj rast iných mikroskopických vláknitých húb. Ich účinok spočíva nie len v deštrukcii bunkovej steny cieľového organizmu, ale aj v degradácii DNA a inhibícii bunkového cyklu mikroskopických vláknitých húb. Killer toxíny produkované kvasinkami druhu Wickerhamomyces anomalus a Torulaspora delbrueckii dokážu účinne inhibovať rast aflatoxinogénnej mikroskopickej huby druhu A. flavus, v závislosti od teploty. Najvyšší inhibičný potenciál dosahujú vyprodukované killer toxíny pri teplote 30 °C a naopak žiadny inhibičný potenciál neprejavujú pri teplotách nižších ako je 15 °C. Okrem teploty, ovplyvňuje účinok killer toxínov aj hodnota pH. Pri nižšom pH ich schopnosť eliminovať A. flavus stúpa, naopak so zvyšujúcim sa pH prostredia, táto schopnosť klesá. Význam aplikácie killer toxínov však spočíva skôr v prevencii produkcie mykotoxínov, nakoľko killer toxíny, nedokážu priamo degradovať mykotoxíny. Ich účinok spočíva v eliminácii mikroskopických vláknitých húb, prostredníctvom narušenia integrity ich bunkovej steny, čím sa zabráni aj potenciálnej produkcii mykotoxínov.
Degradácia a biotransformácia
Medzi ďalšie zaujímavé metódy odstraňovania aflatoxínov z potravín a krmív patrí aj biodegradácia alebo biotransformácia. Väčšina kvasiniek je schopných produkovať rôzne enzýmy, ktoré zohrávajú kľúčovú úlohu v degradácii aflatoxínov. Mnohé enzýmy produkované kvasinkami následne narúšajú toxickú štruktúru aflatoxínov, za vzniku menej toxických alebo netoxických zlúčenín. Prvá zmienka o mikrobiálnej degradácii AFB1 bola publikovaná ešte v roku 1966 a od tejto doby sa enzymatickou degradáciou aflatoxínov, začalo zaoberať mnoho ďalších štúdii. Avšak len niekoľko z nich odhalilo aj pravé produkty degradácie aflatoxínov a preverilo ich toxicitu. Vo všeobecnosti rozlišujeme 2 hlavné spôsoby detoxikácie AFB1. Prvou možnosťou je narušenie difuránového kruhu molekuly, alebo druhá možnosť – narušenie kumarínovej štruktúry AFB1. K významným enzýmom, ktoré sú schopné degradovať aflatoxíny alebo aflatoxinogénne mikroskopické vláknité huby, patria mnohé hydrolytické enzýmy ako je napríklad β – 1,3 – glukanáza, chitináza, amyláza, celuláza, mangánová peroxidáza a mnohé iné. Zaujímavý potenciál v degradácii AFB1 ma napríklad lakáza zo Saccharomyces cerevisiae, ktorá dokáže účinne znížiť koncentráciu AFB1, až o 91 %. Pri degradácii AFB1, pritom dochádza k narušeniu kľúčových toxických skupín mykotoxínu – dvojitej väzby v rámci difuranového kruhu a k narušeniu laktónového kruhu v kumarínovej časti molekuly. Výsledkom enzymatickej degradácie je vznik 4 hlavných degradačných produktov (C16H22O4, C14H16O2, C7H16N6O a C24H30O6), ktoré vykazujú po testoch na potkaních hepatocytoch minimálny toxický účinok. Kvasinky ako Sacharomyces cervisiae RC016, S. boulardii RC009 a Kluveromyces marxianus VM003, dokážu účinne znížiť koncentráciu AFM1 v mlieku v rozmedzí od 30 – 70 % počas 24 hodín. Po 48 hodinách koinkubácie, sú všetky kvasinky schopné degradovať minimálne 80 % AFM1 v mlieku, za vzniku rôznych degradačných produktov. Všetky produkty degradácie pritom nevykazujú žiadny cytotoxický efekt. Kvasinky izolované z bachorovej tekutiny dobytka – K. marxianus a P. kudriavzevii, dokážu degradovať AFB1 v rozmedzí od 86 – 93 % už po 12 hodinách v in vitro podmienkach. Kvasinka druhu Candida tropicalis MY115, napríklad dokáže zdegradovať až 77 % AFB2 prítomného v obilnej kaši.
Kvasinky v úlohe bioadsorbentov
Niektoré druhy kvasiniek dokážu okrem inhibície a degradácie mykotoxínov, tiež aflatoxíny účinne viazať. Táto schopnosť vyplýva predovšetkým z unikátnej štruktúry ich bunkovej steny, ktorá je tvorená vonkajšou vrstvou pozostávajúcou z manoproteínov a vnútornou vrstvou tvorenou β – glukánovými reťazcami spojenými s chitínom a manoproteínmi. Ku kľúčovým komponentom pre bioadsorbciu aflatoxínov patria práve hydroxylová skupina β – 1,3 – glukánu, ktorá sa viaže s hydroxylovou, ketónovou alebo laktónovou skupinou aflatoxínu a následne β – 1,6 – glukány, posilňujú stabilitu tohto komplexu prostredníctvom van der Waalsových síl. Zásadnú rolu v tomto mechanizme plní práve hrúbka vrstvy β – glukánov, čím je táto vrstva hrubšia, tým je mechanizmus bioadsorbcie účinnejší. Samotná bioadsorbčná kapacita kvasiniek samozrejme závisí aj od koncentrácie aflatoxínov v prostredí, teploty, pH a mnohých ďalších. Teplom usmrtené bunky kvasinky druhu S. cerevisiae A18, dokážu adsorbovať 73,03 % AFB1. Pričom je známe, že adsorbčná kapacita kvasiniek sa zvyšuje práve v prípade usmrtených buniek kvasiniek, pretože teplo zvyšuje permeabilitu cytoplazmatickej membrány týchto bioadsorbentov. Vplyv na adsorbčnú schopnosť kvasiniek má aj pH prostredia. Niektoré kmene kvasiniek majú vyššiu adsorbčnú schopnosť pri pH 3 alebo 8, naopak pri pH 6, sa ich adsorbčná kapacita výrazne znižuje (Tabuľka 1).
Tabuľka 1: Vplyv pH na schopnosť rôznych kmeňov kvasinky Saccharomyces cerevisiae viazať AFB1 (Zdroj: Dogi et al., (2011), upravené: Vojčíková).
| Kmene kvasinky S. cerevisiae | pH | ||
| 3 | 6 | 8 | |
| RC008 | 72.6 % | 49.6 % | 81.8 % |
| RC009 | 85.3 % | 41.6 % | 84.2 % |
| RC016 | 94.5 % | 55.6 % | 88.6 % |
K ďalším faktorom ovplyvňujúcim adsorbčnú schopnosť kvasiniek patrí teplota a čas expozície. Kvasinka druhu S. boulardii (109 CFU/ml), dokáže účinne naviazať až 96,88 % AFM1 v mlieku, pri počiatočnej koncentrácii mykotoxínu – 0,75 ng/ml, pri 37 °C, počas 90 minút. Zo znižujúcou sa teplotou, sa schopnosť kvasinky viazať AFM1 v mlieku postupne znižuje a najvyššiu adsorbčnú schopnosť kvasinka dosahuje počas prvých minút pôsobenia. Zaujímavé výsledky vo väzbe AFB1 z kontaminovaného krmiva, dosahuje aj extrakt bunkovej steny kvasiniek. Z dostupných štúdií je známe, že u potkanov, ktoré boli kŕmené krmivom kontaminovaným AFB1, došlo vďaka podávaniu extraktu bankovej steny kvasiniek k vyviazaniu 7,6 µg/l AFB1, z pôvodných 10 µg/l. So schopnosťou adsorbcie mykotoxínov z potravín a krmív sú spájané mnohé druhy probiotických kvasiniek, k tým najviac preskúmaným, patrí predovšetkým Saccharomyces cerevisiae, S. boulardii, Kluyveromyces marxianus alebo K. lactis. Účinok aplikácie probiotických kvasiniek schopných viazať aflatoxíny z prostredia sa značne zvyšuje, v prípade použitia kombinácie viacerých druhov kvasiniek, poprípade aj s využitím baktérii mliečneho kvasenia.
Záver
V dnešnej dobe, je stále pomerne preferovaná aplikácia konzervačných látok a fungicídov, ktoré zvyšujú vývoj rezistentných kmeňov húb a majú negatívny vplyv na životné prostredie a ľudské zdravie. Väčšina fyzikálnych a chemických metód eliminácie aflatoxínov v potravinách má nízku účinnosť a negatívny dopad na kvalitu potravín. Preto je potrebné zvážiť aplikáciu biologických metód kontroly rastu aflatoxinogénnych vláknitých húb, produkcie ich mykotoxínov a znížiť tak bezpečnostné riziká a dopad na životné prostredie. Avšak, aj napriek rozsiahlemu zoznamu účinných kmeňov kvasiniek, ktoré sa môžu potenciálne aplikovať v poľnohospodárstve, len niekoľko z nich je registrovaných a komerčne dostupných na ochranu rastlín proti mykotoxínom. Nízky trend počtu vyvinutých produktov na báze kvasiniek je spôsobený najmä nedostatočne preskúmaným mechanizmom ich účinku, nákladmi na registráciu a absenciou komerčných partnerov. Prvou zaregistrovanou a komerčne využívanou kvasinkou, ktorá má potenciál produkovať antifungálne enzýmy – proteázy a VOCs, bola kvasinka Candida oleophila. Neskôr, boli zaregistrované aj kvasinky druhu Aureobasidium pullulans, Cryptococcus albidus, Metschnikowia fructicola a Saccharomyces cerevisiae. Aplikácia kvasiniek ako prostriedkov biologickej kontroly voči mikroskopickým vláknitým hubám a ich mykotoxínom má na rozdiel od iných mikroorganizmom niekoľko výhod. Kvasinky majú vo všeobecnosti jednoduché požiadavky na rast, môžu rásť rýchlejšie, dokonca aj na suchých povrchoch a nie je známe, že by produkovali toxické metabolity ako mikroskopické vláknité huby alebo baktérie. Aj napriek výhodám, ktoré biologická eliminácia aflatoxínov prostredníctvom kvasiniek ponúka, je tento spôsob biokontroly rastlín, potravín a krmív pomerne neprebádanou a neustále odsúvanou témou.
Použitá literatúra
ABU MEJDAD, N.M.J.A. – AL SAADOON, A.H. – AL BADRAN, A.I. – MINATI, M.H. 2020. Optimum conditions of killer toxins produced by Torulaspora delbrueckii and Wickerhamomyces anomalus and their action as antifungal agents. In Bulletin of the National Research Centre, vol. 44, n. 1, p. 1 – 9. https://doi.org/10.1186/s42269-020-00407-8
DOGI, C.A. – ARMANDO, R. – LUDUEÑA, R. – DE MORENO DE LEBLANC, A. – ROSA, C.A.R. – DALCERO, A. – CAVAGLIERI, L. 2011. Saccharomyces cerevisiae strains retain their viability and aflatoxin B1 binding ability under gastrointestinal conditions and improve ruminal fermentation. In Food Additives & Contaminants: Part A, vol. 28, n. 12, p. 1705 – 1711. https://doi.org/10.1080/19440049.2011.605771
FREIMOSER, F.M. – RUEDA MEJIA, M.P. – TILOCCA, B. – MIGHELI, Q. 2019. Biocontrol yeasts: mechanisms and applications. In World Journal of Microbiology and Biotechnology, vol. 35, n. 10, p. 1 – 19. https://doi.org/10.1007/s11274-019-2728-4
GHOFRANI TABARI, D. – KERMANSHAHI, H. – GOLIAN, A. – MAJIDZADEH HERAVI, R. 2018. In vitro binding potentials of bentonite, yeast cell wall and lactic acid bacteria for aflatoxin B1 and ochratoxin A. In Iranian journal of toxicology, vol. 12, n. 2, p. 7 – 13. http://ijt.arakmu.ac.ir/article-1-642-en.html
INTANOO, M. – KONGKEITKAJORN, M.B. – PATTARAJINDA, V. – BERNARD, J.K. – CALLAWAY, T.R. – SURIYASATHAPORN, W. – PHASUK, Y. 2018. Isolation and screening of aflatoxin detoxifying yeast and bacteria from ruminal fluids to reduce aflatoxin B1 contamination in dairy cattle feed. In Journal of applied microbiology, vol. 125, n. 6, p. 1603 –1613. https://doi.org/10.1111/jam.14060
JAIBANGYANG, S. – NASANIT, R. – LIMTONG, S. 2020. Biological control of aflatoxin – producing Aspergillus flavus by volatile organic compound producing antagonistic yeasts. In BioControl, vol. 65, p. 377 – 386. https://doi.org/10.1007/s10526-020-09996-9
JAIBANGYANG, S. – NASANIT, R. – LIMTONG, S. 2021. Effects of temperature and relative humidity on Aflatoxin B1 reduction in corn grains and antagonistic activities against Aflatoxin producing Aspergillus flavus by a volatile organic compound producing yeast, Kwoniella heveanensis DMKU – CE82. In BioControl, vol. 66, p. 433 – 443. https://doi.org/10.1007/s10526-021-10082-x
KHADIVI, B.R. – RAZAVILAR, V. – ANVAR, S.A.A. – AKBARI, A.B. 2022. Removal Of Aflatoxin M1 From The Reconstituted Milk By Adding Three Probiotics Lactobacillus Rhamnosus, L. Plantarum, And Saccharomyces Boulardii Using The Quantification Of Hplc Method, In Journal of Food Microbiology, vol.8, n. 4, p. 12 – 24. https://www.sid.ir/paper/412247/en
LUO, Y. – LIU, X. – YUAN, L. – LI, J. 2020. Complicated interactions between bioadsorbents and mycotoxins during mycotoxin adsorption: Current research and future prospects. In Trends in Food Science & Technology, vol. 96, p. 127 – 134. https://doi.org/10.1016/j.tifs.2019.12.012
MANNAZZU, I. – DOMIZIO, P. – CARBONI, G. – ZARA, S. – ZARA, G. – COMITINI, F. – BUDRONI, M. – CIANI, M. 2019. Yeast killer toxins: from ecological significance to application. In Critical Reviews in Biotechnology. vol. 39, n. 5, p. 603 – 617. https://doi.org/10.1080/07388551.2019.1601679
MANNAZZU, I. – DOMIZIO, P. – CARBONI, G. – ZARA, S. – ZARA, G. – COMITINI, F. – CIANI, M. 2019. Yeast killer toxins: From ecological significance to application. In Critical reviews in biotechnology, vol. 39, n. 5, p. 603 – 617. https://doi.org/10.1080/07388551.2019.1601679
MARTINEZ, M.P. – MAGNOLI, A.P. – PEREYRA, M.G. – CAVAGLIERI, L. 2019. Probiotic bacteria and yeasts adsorb aflatoxin M1 in milk and degrade it to less toxic AFM1 metabolites. Toxicon, vol. 172, p. 1 – 7. https://doi.org/10.1016/j.toxicon.2019.10.001
PICKOVA, D. – OSTRY, V. – TOMAN, J. – MALIR, F. 2021. Aflatoxins: History, significant milestones, recent data on their toxicity and ways to mitigation. In Toxins, vol. 13, n. 6, p. 399. https://doi.org/10.3390/toxins13060399
ROSSITER, S. 2019. Food and health information. (Online). 21.3.2019. Dostupné na: https://www.ifis.org/blog/aflatoxins-overview-and-definitions [cit. 2023.04.06].
RUSHING, B.R. – SELIM, M.I. 2019. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. In Food and chemical toxicology, vol. 124, p. 81 – 100. https://doi.org/10.1016/j.fct.2018.11.047
VANHOUTTE, I. – AUDENAERT, K. – DE GELDER, L. 2016. Biodegradation of mycotoxins: Tales from known and unexplored worlds. In Frontiers in Microbiology, vol. 7, n. 561 p. 561. https://doi.org/10.3389/fmicb.2016.00561
YANG, T. – WANG, C. – LI, C. – SUN, R. – YANG, M. 2023. Antagonistic effects of volatile organic compounds of Saccharomyces cerevisiae NJ – 1 on the growth and toxicity of Aspergillus flavus. In Biological Control, vol. 117, p. 10 – 15. https://doi.org/10.1016/j.biocontrol.2022.105093
YIANNIKOURIS, A. – APAJALAHTI, J. – KETTUNEN, H. – OJANPERÄ, S. – BELL, A.N. – KEEGAN, J.D. – MORAN, C.A. 2021. Efficient aflatoxin B1 sequestration by yeast cell wall extract and hydrated sodium calcium aluminosilicate evaluated using a multimodal in vitro and ex vivo methodology. In Toxins, vol. 13, n. 1, p. 24. https://doi.org/10.3390/toxins13010024

Leave a Reply