Viktória Uzsáková, Miroslava Hlebová
Univerzita Svätého Cyrila a Metoda v Trnave, Fakulta prírodných vied, Katedre biológie
Mykotoxíny a potraviny
Hlavným dôvodom obáv prítomnosti mikroskopických húb v potravinárskych komoditách je ich schopnosť produkcie sekundárnych metabolitov – mykotoxínov. Okrem ekonomických strát je nežiaduci výskyt mykotoxínov v potravinách spojený s ich toxickým účinkom ohrozujúcim zdravie ľudí i zvierat, nakoľko sú karcinogénne, mutagénne, teratogénne, estrogénne, hemoragické, imunotoxické, nefrotoxické, hepatotoxické, dermatoxické a neurotoxické. V súčasnosti je známych viac ako 400 mykotoxínov, produkovanými najmä mikroskopickými vláknitými hubami Aspergillus sp., Fusarium sp. a Penicilium sp., pričom každá huba môže produkovať viac ako jeden mykotoxín, ktorý je chemicky a toxikodynamicky veľmi rozmanitý. Zásadným problémom v potravinárstve je vysoká stabilita týchto sekundárnych metabolitov, ktorá im zabezpečuje odolnosť počas rôznych technologických potravinárskych procesov spracovania, čo vedie ešte k väčším obavám o bezpečnosť potravín. Medzi najčastejšie sa vyskytujúce a najdôležitejšie mykotoxíny v potravinách patria aflatoxíny, ochratoxín A, fumonizíny, deoxynivalenol, zearalenón, a patulín.
Mykotoxíny vďaka všadeprítomnej povahe mikroskopických húb, sa stávajú čoraz väčšou hrozbou a ich výskyt v potravinách nemožno ignorovať. V poľnohospodárskom a potravinárskom priemysle sa využíva množstvo chemických a fyzikálnych metód určených na ochranu plodín a potravín pred mikroskopickými hubami. Taktiež sú bežnou súčasťou potravín a nápojov chemické konzervačné látky, ktoré predlžujú ich trvanlivosť a zároveň zabraňujú kontaminácii, no v mnohých prípadoch ovplyvňujú zloženie živín v potravinách. V dnešnej dobe však stúpa záujem o prirodzenejšie a cenovo menej nákladné metódy dekontaminácie a konzervácie potravín. Bioprotekcia a biokonzervácia potravín je veľmi sľubnou alternatívou s možnosťou použitia stoviek až tisícov vhodných mikroorganizmov a ich metabolitov.
Baktérie mliečneho kvasenia
Baktérie mliečneho kvasenia (BMK) sú na čele zoznamu mikroorganizmov, určených na biologickú kontrolu, vďaka ich dlhoročnej bezpečnej histórii využívania v potravinárskom priemysle a ich prirodzenému výskytu v gastrointestinálnom trakte, čo im zabezpečuje účinnosť voči toxinogénnym mikroskopickým hubám. Úloha kmeňov BMK nie je obmedzená len na inhibíciu rastu húb, ale niektoré kmene sú schopné interagovať s mykotoxínmi mikroskopických húb, čo vedie k ich následnej inaktivácii, alebo k ich odstráneniu prostredníctvom väzby na bunkové steny laktobacilov.
Všetky BMK sú grampozitívne, zvyčajne nemotilné, netvoriace spóry, aerotolerantné koky, kokobacily alebo tyčinky, ktoré produkujú kyselinu mliečnu ako hlavný produkt metabolizmu uhľohydrátov počas fermentácie. BMK patria do radu Lactobacillales , ktorý zahŕňa 6 čeľadí, 36 rodov a viac ako 200 druhov. Vo veľkej miere sa tieto baktérie využívajú pri výrobe rôznych fermentovaných potravín a nápojov, kde prispievajú k zlepšeniu trvanlivosti, organoleptických vlastností a výživovej hodnoty potravín. Medzi priemyselne významné rody patria Lactococcus, Enterococcus, Oenococcus, Pediococcus, Streptococcus, Leuconostoc a Lactobacillus.Antimykotický potenciál BMK je spájaný najmä s rodmi Lactobacillus, Bifidobacterium, Streptococcus a Lactococcus, pričom rod Lactobacillus patrí medzi najdôležitejšie rody.
Antifungálny účinok baktérií mliečneho kvasenia
BMK sa považujú za „zelené konzervačné látky“ z dôvodu ich schopnosti inhibovať rast mikroskopických húb v potravinách v dôsledku produkcie množstva antifungálnych metabolitov. Organické kyseliny sa doteraz považujú za hlavné metabolity BMK, ktoré dramaticky ovplyvňujú rast húb inhibíciou rastu ich mycélia. Organické kyseliny v protonizovanej alebo nedisociovanej forme majú lipofilnú povahu, a preto ľahko difundujú cez bunkovú membránu húb a hromadia sa v cytoplazme. Z organických kyselín produkovaných kmeňmi BMK sa kyselina mliečna považuje za hlavný metabolit, produkovaný v najvyššom množstve na rozdiel od ostatných organických kyselín. Napriek tomu je však známe, že kyselina mliečna vykazuje v porovnaní s inými organickými kyselinami, ako je kyselina octová a kyselina propiónová, menšiu inhibičnú aktivitu voči rastu mikroskopických vláknitých húb. Ďalšími významnými fungicídmi sú karboxylové kyseliny, fenolové kyseliny, cyklické dipeptidy, peroxid vodíka, reuterín a diacetyl. Obzvlášť zaujímavou zlúčeninou je reuterín, ktorý je produkovaný rôznymi rodmi BMK za anaeróbnych podmienok. Reuterín potláča aktivitu ribonukleázy, enzýmu zapojeného do biosyntézy DNA.
Inhibícia produkcie mykotoxínov
Priamy vplyv BMK na produkciu mykotoxínov je niekedy dôsledkom zastavenia rastu mikroskopických vláknitých húb v dôsledku konkurencie o priestor a živiny a produkcie kyselín a antimykotických metabolitov, alebo kombináciou týchto faktorov. Predpokladá sa, že začiatok produkcie mykotoxínov koreluje s rastom húb, pretože produkcia mykotoxínov začína na konci rastovej fázy húb. Preto je inhibícia rastu toxinogénnych húb často považovaná za najúčinnejšiu stratégiu na odvrátenie produkcie mykotoxínov. Znížená produkcia mykotoxínov v dôsledku spomalenia rastu je však možná iba vtedy, ak je rast mikroskopických vláknitých húb znížený na takú úroveň, pri ktorej nedokážu produkovať mykotoxíny. Akonáhle však dôjde k produkcií mykotoxínov je nutné ich odstránenie – dekontaminácia.
Odstránenie mykotoxínov adsorpciou pomocou BMK
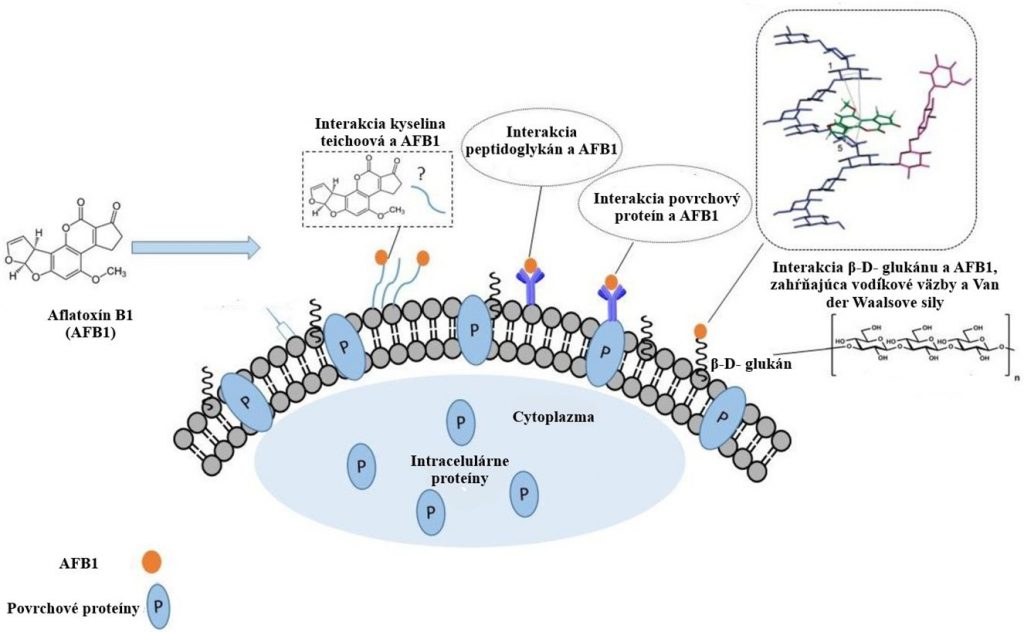
Adsorpcia mykotoxínov prostredníctvom komponentov bunkovej steny je najbežnejším mechanizmom odstraňovania mykotoxínov pomocou BMK zo syntetických médií, potravín alebo krmív. BMK adsorbujú mykotoxíny na svoje funkčné skupiny bunkovej steny. Typická bunková stena BMK, rovnako ako mnoho ďalších grampozitívnych baktérií, obsahuje hrubý viacvrstvový peptidoglykán ktorý je poprepájaný polysacharidmi, proteínmi, kyselinou lipoteichoovou a teichoovou. Polysacharidy a peptidoglykány sa však považujú za hlavné zložky BMK zodpovedné za odstránenie mykotoxínov.
S adsorpciou mykotoxínov sú však spojené mnohé otázky a obavy. Jednou z nich je aj bezpečnosť mykotoxínu naviazaného na bunkovú stenu BMK, ktorý prechádza črevným traktom človeka. Výsledky štúdií však preukázali zníženú adhéziu tohto komplexu k slizniciam. Dôležitým problémom týkajúcim sa odstránenia mykotoxínov prostredníctvom väzby na bakteriálnu bunkovú stenu, je uvoľnenie týchto viazaných mykotoxínov z bakteriálnej bunkovej steny v závislosti od typu väzby a podmienok prostredia. Napríklad je pravdepodobné, že extracelulárne a nekovalentne viazaný mykotoxín sa uvoľní, vplyvom účinku peristaltických pohybov, pH, solí, enzýmov, žalúdočných a slinných sekrétov. Z týchto dôvodov by sa mali pri využití druhov BMK používať stratégie zapúzdrenia aby sa zabránilo desorpcii mykotoxínov.
Degradácia mykotoxínov pomocou BMK
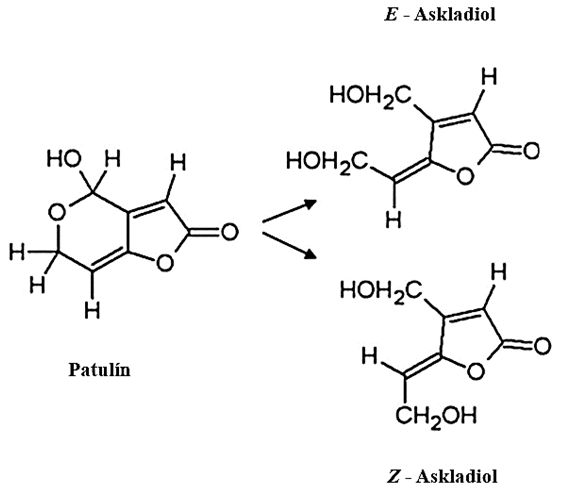
Biologická degradácia mykotoxínov je druhým, po adsorpcii, najznámejším mechanizmom redukcie mykotoxínov v potravinách alebo krmivách pomocou BMK. Aj keď je biodegradácia toxínov trvalým riešením, väzba na bunkovú stenu sa stále považuje za výhodnú pred metabolickou degradáciou určitých toxínov z nasledujúcich dôvodov: biodegradácia nie je len časovo náročný proces, ale môže tiež premieňať niektoré mykotoxíny na ešte škodlivejšie metabolity, ako v prípade aflatoxínu B1, ktorý sa biotransformuje na škodlivý metabolit aflatoxikol. Účinná degradácia pomocou BMK sa však preukázala v prípade mnohých iných mykotoxínov, ako napríklad ochratoxín A, zearalenón a patulín, kedy degradačné produkty vykazovali nižšiu toxicitu v porovnaní s pôvodnými mykotoxínmi.
Ochrana poskytovaná BMK pred toxickými účinkami mykotoxínov
Gastrointestinálny trakt je primárnym cieľom mykotoxínov, vedúcich k zdraviu škodlivým chronickým alebo akútnym účinkom vrátane apoptózy buniek, defektov imunitného systému, narušenia črevnej slizničnej bariéry a absorpcie živín. Niektoré z mykotoxínov ako napríklad ochratoxín A spôsobujú dysbiózu črevnej mikrobioty. Výsledkom dysbiózy je nerovnováha v zložení mikrobiómu, ktorá vzniká napríklad pri dlhodobom užívaní antibiotík, kde sa následne v čreve zmení pomer komenzálnych a patogénnych baktérií, čoho dôsledkom môžu byť ďalšie ochorenia ako zápaly čreva a metabolické ochorenia. Preto sa vždy odporúča užívanie probiotík, ktorých súčasťou sú práve BMK. Negatívne účinky mykotoxínov sú preukázané aj pri vzniku nádorových ochorení tráviaceho traktu : hepatocelulárny karcinóm – aflatoxín B1 alebo rakovina pažeráku – fumonozín B1. Pri všetkých prípadoch BMK dokázali zmierniť alebo zabrániť spomínaným účinkom mykotoxínov a preto ich využitie ako kokultúry v mnohých potravinách a nápojoch prináša viacero benefitov.
Záver
Antimykotický potenciál BMK a ich status GRAS (Všeobecne uznávaný ako bezpečný, angl. Generally recognized as safe) ich predstavuje ako ideálnych kandidátov na použitie ako agentov biologickej kontroly a biokonzervácie v rôznych potravinárskych komoditách vrátane mliečnych výrobkov, džúsov, pekárenských výrobkov, mäsa, ovocia, zeleniny a krmív pre zvieratá na zmiernenie negatívneho dopadu mikroskopických vláknitých húb bez poškodenia samotných potravín. Úloha BMK sa neobmedzuje len na inhibíciu fungálneho rastu, ale niektoré druhy BMK, ako napríklad Lactobacillus rhamnosus, L. acidophilus, L. plantarum, L. lactis, Streptococcus thermophilus, a Bifidobacterium bifidum taktiež interagujú s mykotoxínmi húb, čo vedie k ich inaktivácii alebo odstráneniu. Niektoré dobre definované probiotické kmene rodov Lactobacillus a Bifidobacterium majú dvojakú funkciu: mykotoxíny nielen degradujú počas vhodného fermentačného procesu a adsorbujú z povrchu potraviny alebo krmiva, ale ich prítomnosť v potravinách alebo krmivách prináša ďalšie zdravotné výhody spotrebiteľom.
Použitá literatúra
Ahlberg, S. H., Joutsjoki, V., & Korhonen, H. J. (2015). Potential of lactic acid bacteria in aflatoxin risk mitigation. International journal of food microbiology, 207, 87-102. https://doi.org/10.1016/j.ijfoodmicro.2015.04.042
Alassane-Kpembi, I., Pinton, P., & Oswald, I. P. (2019). Effects of Mycotoxins on the Intestine,Toxins, 11(3), 159. https://doi.org/10.3390/toxins11030159
Crowley, S., Mahony, J., & van Sinderen, D. (2013). Current perspectives on antifungal lactic acid bacteria as natural bio‐preservatives. Trends in Food Science & Technology, 33(2), 93–109. https://doi.org/10.1016/j.tifs.2013.07.004
Dagnas, S., Gauvry, E., Onno, B., & Membre, J. M. (2015). Quantifying effect of lactic, acetic, and propionic acids on growth of molds isolated from spoiled bakery products. Journal of food protection, 78(9), 1689-1698. https://doi.org/10.4315/0362-028X.JFP-15-046
Guo, M., Huang, K., Chen, S., Qi, X., He, X., Cheng, W. H., … & Xu, W. (2014). Combination of metagenomics and culture-based methods to study the interaction between ochratoxin a and gut microbiota. Toxicological Sciences, 141(1), 314-323. https://doi.org/10.1093/toxsci/kfu128
Hawar, S., Vevers, W., Karieb, S., Ali, B. K., Billington, R., & Beal, J. (2013). Biotransformation of patulin to hydroascladiol by Lactobacillus plantarum. Food Control, 34(2), 502-508. https://doi.org/10.1016/j.foodcont.2013.05.023
Chapot‐Chartier, M. P., & Kulakauskas, S. (2014). Cell wall structure and function in lactic acid bacteria. Microbial Cell Factories, 13(1), 9. https://doi.org/10.1186/1475-2859-13-s1-s9ň
Chen, C., Riley, R. T., & Wu, F. (2018). Dietary fumonisin and growth impairment in children and animals: A review. Comprehensive reviews in food science and food safety, 17(6), 1448-1464. https://doi.org/10.1111/1541-4337.12392
Lee, H. J., & Ryu, D. (2017). Worldwide occurrence of mycotoxins in cereals and cereal-derived food products: public health perspectives of their co-occurrence. Journal of Agricultural and Food Chemistry, 65(33), 7034-7051. https://doi.org/10.1021/acs.jafc.6b04847
Liew, W. P. P., Nurul-Adilah, Z., Than, L. T., & Mohd-Redzwan, S. (2018). The binding efficiency and interaction of Lactobacillus casei Shirota toward aflatoxin B1. Frontiers in microbiology, 9, 1503. https://doi.org/10.3389/fmicb.2018.01503
Muhialdin, B. J., Saari, N., & Meor Hussin, A. S. (2020). Review on the Biological Detoxification of Mycotoxins Using Lactic Acid Bacteria to Enhance the Sustainability of Foods Supply. Molecules, 25(11), 2655. https://doi.org/10.3390/molecules25112655
Perczak, A., Goliński, P., Bryła, M., & Waśkiewicz, A. (2018). The efficiency of lactic acid bacteria against pathogenic fungi and mycotoxins. Archives of Industrial Hygiene and Toxicology, 69(1), 32-45. https://doi.org/10.2478/aiht-2018-69-3051
Sadiq, F. A., Yan, B., Tian, F., Zhao, J., Zhang, H., & Chen, W. (2019). Lactic acid bacteria as antifungal and anti‐mycotoxigenic agents: a comprehensive review. Comprehensive reviews in food science and food safety, 18(5), 1403-1436. https://doi.org/10.1111/1541-4337.12481
Sepová, H. K., Dudík, B., & Bilková, A. (2017). Črevná mikrobiota: jej vývin a vzťah k vzniku niektorých ochorení Gut microbiota: its development and relation to certain diseases. Česká a Slovenská Farmácie. 66, 267-273. Verheecke, C., Liboz, T., & Mathieu, F. (2016). Microbial degradation of aflatoxin B1: current status and future advances. International Journal of Food Microbiology, 237, 1-9. https://doi.org/10.1016/j.ijfoodmicro.2016.07.028

Leave a Reply